��Ŀ����
����Ŀ����ͼ��ʵ������ȡSO2����֤SO2ijЩ���ʵ�װ��ͼ�����۲쵽װ�â����е���ɫ�������ɣ����е���ˮ��ɫ����֪����Br2����ˮ�ʺ���ɫ������ش�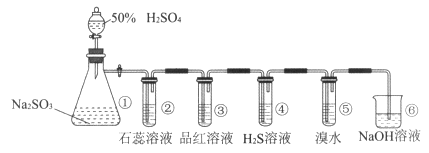
��1�����з�����Ӧ�����ӷ���ʽ����
��2�����е�ʵ����������
��3���۵�ʵ�������� �� ֤��SO2���ԡ�
��4������SO2������
��5�����з�Ӧ��������ǿ�ᣬ�÷�Ӧ�����ӷ���ʽ�� �� ��1 molSO2���뷴Ӧʱ��ת�Ƶ��ӵ����ʵ�������
��6������������
���𰸡�
��1��SO32-+2H+= H2O+SO2��
��2����Һ��Ϊ��ɫ
��3��Ʒ����Һ��ɫ��Ư����
��4������
��5��SO2+Br2+2H2O=4H++2Br-+SO42-��2mol
��6������β������ֹ������Ⱦ
��������
��1������Ϊ�������ƺ����ᷴӦ���ɶ����������壬��Ӧ�����ӷ���ʽΪSO32-+2H+= H2O+SO2����
��2�����������ˮ��Ӧ���������ᣬ������Ϊ���ᣬ����ʹ��ɫʯ����Һ��죬���е�ʵ����������Һ��Ϊ��ɫ��
��3������������Ʒ�컯��������ɫ���ʣ���ʹƷ����Һ��ɫ��֤�������������Ư���ԣ�
��4�������е���ɫ�������ɣ�˵��SO2�����ⷴӦ����S��SO2����������
��5��������ˮ��ɫ����Ӧ��������ǿ�ᣬ�÷�Ӧ�����ӷ���ʽ��SO2+Br2+2H2O=4H++2Br-+SO42- ����Ԫ�صĻ��ϼ���+4��Ϊ+6����1 molSO2 ���뷴Ӧʱ��ת�Ƶ��ӵ����ʵ�����2mol��
��6�����������ж�������ֱ���ŷŵ������У��������������������Ʒ�Ӧ�����������ƺ�ˮ������������������Һ����β������ֹ������Ⱦ��
��1��ǿ��������������ƺ����ᷴӦ���ɶ�����������
��2����ɫʯ����Һ��֤��Һ������ԣ������������������������ˮ������
��3������Ʒ�죬�뵽�����������Ư���ԣ���Ʒ�컯��������ɫ�������Ȼ�ָ���ɫ��
��4�������е���ɫ�������ɣ�˵��SO2�����ⷴӦ����S��SO2����������
��5��������������ˮ����ˮ�����������HBr�����ᣩ
��6���ж�������β����������������������������ü���Һ���գ�

 ��Уͨ��֤��Ч��ҵϵ�д�
��Уͨ��֤��Ч��ҵϵ�д�����Ŀ��ij��ȤС���Ʊ�����������������
ʵ��1 |
| ʵ������ |
Һ���Ϸ�������ɫ��״������Ѹ�ٱ�Ϊ����ɫ�����Թܱ����к��ɫ�������ɣ� |
��1��ʵ��1�в�����ɫ���������ӷ���ʽ�� ��
��2��Ϊ��̽�����������ɫ��ԭ��С��ͬѧչ������̽���� �ټ�ͬѧ�Ʋ����ɫ����ΪFe��OH��2��Fe��OH��3�����������Ϻ���ݵ�ɫԭ����Ϊ��ɫ�ͺ��ɫ�ĵ���ɫ�������ǻ���ɫ�������ʵ��֤ʵ����ɫ�����в�����Fe��OH��3 �� ������ ��
����ͬѧ�������ף�Fe��OH��2�ڴ���SO42�����ڵ�������γ�Fe6��SO4��2��OH��4O3��һ��������ʽ���Σ�������ƶԱ�ʵ��֤ʵ�ü��裺���Թ��м��� �� �����Թ��м��� �� ��������ʵ��1��ͬ�������Ǹü��費������
����ͬѧ�����������ף�Fe��OH��2�������н�ǿ���������ܣ�����ɫ��������Fe��OH��2��������Fe2+�����Ʋ����õ�����������Һ��Ũ��ӦԽСԽ�ã�����������ҺŨ��ӦԽ��Խ�ã����������ʵ�鷽����
�Թ���10mL | �μ� | ʵ������ | |
ʵ��2 | 6mol/L | 0.2mol/L FeSO4��Һ | ����������Һ��İ�ɫ������������������ɫ���������³��ֻ���ɫ��Ϊ��ɫ���� |
ʵ��3 | 6mol/L | 0.1mol/L FeSO4��Һ | ����������Һ��İ�ɫ���������м���������ɫ���������³��ײ���Ϊ��ɫ���� |
��ʵ��ó��Ľ����� �� ��˵������ɫ����Fe��OH��2��������Fe2+�����֤���� �� ��ͬѧ��Ϊ��ʵ�鷽��������֤������ɫ����Fe��OH��2��������Fe2+����ģ����貹���ʵ���� �� ֤���ü��������
��3����ͬѧ̽���¶ȶ������������Ʊ�ʵ���Ӱ�죺ȡ��������ɫ��������ˮԡ�м��ȣ���ɫ�ɻ��̱�ף�������״��ɫ�����³���ԭ��Ϊ ��
��4����������ʵ��̽�������������Ƶð�ɫFe��OH��2��������Ҫ���Ƶ�ʵ������ ��
����Ŀ��ij��ѧС�����о�Na2SO3��Һ��FeCl3��Һ���ʼ���Ӧʱ������������ʵ�飺
��1��ȡ1molL��1��Na2SO3��Һ���ڿ����У������pH��ʱ��ı仯������ͼ��ʾ�� 
�������Na2SO3��ҺpH=7.8��������ԭ������ӷ���ʽ�� ��
��tʱ����ڣ������pH���������仯�������ӷ���ʽ������ ��
��2��̽��Na2SO3��Һ��FeCl3��Һʵ�ʷ�Ӧ������� ʵ�颡
װ�� | ���� | ���� |
| ��2mL1molL��1FeCl3��Һ�У���εμ�1moL��1Na2SO3��Һ2mL | ��Һ��ɫ������յú��ɫ��Һ��W�� |
ʵ�颢
װ�� | ���� | ���� |
| ȡ1mL��ҺW���Թ��У�����μӹ������ᣬ�ٵμ�5��BaCl2��Һ | ������ɫ���� |
��ʵ�颢֤������Һ�к������ӣ�
�ڶ�Na2SO3��Һ��FeCl3��Һʵ�ʷ�Ӧ����������ʶ��
��ʶ��Ӧ��Fe3+��ȫת��ΪFe2+ �� W��Һ��c��Fe2+��һ���ܴ�Ӧ�����ӷ���ʽ�� ��
��ʶ��W��Һ��c��Fe2+��Ӧ�ü�С������W��Һ����ʺ��ɫ��
��3��������ʾ��Fe2+�ʵ���ɫ��FeSO3��ī��ɫ��������ʽ������[Fe4��OH��2��SO4��5]��ҺΪ���ɫ�� ��ʵ����ʼ��δ����ī��ɫ������˵��c��Fe2+����С����ԭ�������ӷ���ʽ������ ��
��ʵ����̺ͽ����ʾ��O2��Fe3+��SO42����������ǿ��˳���� ��
����Fe4��OH��2��SO4��5�������ҺW�ʺ��ɫ��ԭ��֮һ�����γɵĻ�ѧ����ʽ�� ��
���ü��������W��Һ�������ж�������������ӷ���ʽ����ԭ���� ��





