��Ŀ����
һ�����������Ҵ�����û������������ܼ����ȼ״����Ч�ʸ߳�32������ط�ӦʽΪC2H5OH + 3O2 =" 2" CO2 + 3H2O����ع�������ͼ�����й��ڸõ�ص�˵������ȷ����
| A���ŵ�����У���Դ�ڲ���H+������������Ǩ�� |
| B��ͨ���Ҵ��ĵ缫�Ǹ��� |
| C���õ�ص�������ӦΪ��4H+ + O2 + 4e��= 2H2O |
| D���øõ����Ϊ��Դ���ö��Ե缫��ⱥ��NaCl��ˮ��Һʱ��ÿ����0.2 mol C2H5OH������������״������������Ϊ26.88 L |
A
��������������ŵ�ʱ���������ĵ���ͨ�����·�������������Ӵ����磬���ڵ�·�е������Ӵ����������������ӴӸ���������������A�����Ҵ�����������Ӧ��ʧȥ���ӣ�����̼Ԫ�صĻ��ϼ����ߣ���B��ȷ����������������������ԭ��Ӧ���õ����ӣ����ݵ��ӡ���ɺ�ԭ���غ�ԭ������C��ȷ��C2H5OH+3O2 =2CO2 +3H2O��12e������n(e��)ת��=12��0.2 mol��������ӦʽΪ2Cl����2e��=Cl2�������ݵ����غ�ԭ������n(Cl2)= n(e��)ת��/2=12��0.2 mol/2=1.2mol��V(Cl2)= 1.2mol��22.4L/mol=26.88L����D��ȷ��
���㣺����ȼ�ϵ�صĹ���ԭ���͵�ⱥ��ʳ��ˮ��ԭ������Ҫ�漰�ڵ�·�������ƶ��ķ��������������缫��Ӧʽ���жϣ��Լ������غ㷨��Ӧ�á�

��ͼ��ʾ������ȼ�ϵ�صĻ����ṹ�����缫a��b�ֱ��븺�����Ӻ�ؾ������������������йظ�ȼ�ϵ�ع���ʱ�������У�����ȷ���ǣ� ��
| A��a�缫һ���Ǹ��� |
| B����X��H+��H+����a�缫ͨ�����ӽ���Ĥ����b�缫 |
| C����x��O2�������ɵ�ˮ����d������ |
| D����Һ�еĵ��������Ǵ�b����a |
����ͼ��ʾװ�ý���ʵ�飬������������ȷ����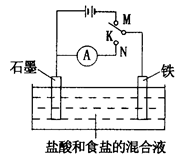
| A��K��N����ʱ��������ʴ |
| B��K��N����ʱ��ʯī�缫�������� |
| C��K��M����ʱ��һ��ʱ�����Һ��pH���� |
| D��K��M����ʱ��ʯī�缫��Ӧ��4OH����4e����2H2O��O2�� |
�˹���������ܹ�����̫���ܣ���CO2��H2O�Ʊ���ѧԭ�ϣ���ͼ��ͨ���˹���������Ʊ�
HCOOH��ԭ��ʾ��ͼ������˵������ȷ���ǣ� �� 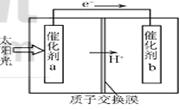
| A���ù����ǽ�̫����ת��Ϊ��ѧ�ܵĹ��� |
| B������a���淢��������Ӧ����O2���� |
| C������a�������Լ���������b����������ǿ |
| D������b����ķ�Ӧ��CO2 +2H++2eһ=HCOOH |
ijС����������װ�ý��е绯ѧʵ�飬����ʵ�������Ԥ��������ȷ����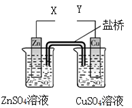
| A��X��Y����������ӣ�������Cu������Zn�� |
| B��X��Y����������ӣ���Zn����Fe��õ������� |
| C��X��Y�ֱ����Դ����������+����������Cu���������� |
| D��X��Y�ֱ����Դ����������+����������Zn���������� |
ijС��Ϊ�о��绯ѧԭ���������ͼװ�á�������������ȷ���ǣ� ��
| A��a��b������ʱ����Ƭ�ϻ��н���ͭ���� |
| B��a��b�õ�������ʱ��ͭƬ�Ϸ����ķ�ӦΪ��Cu2�� + 2e��= Cu |
| C������a��b�Ƿ����ӣ���Ƭ�����ܽ⣬��Һ����ɫ���dz��ɫ |
| D��a��b�õ�������ʱ����Ƭ�Ϸ����ķ�ӦΪ��Fe �� 3e��= Fe3�� |
��ͼ�ǵ��CuCl2��Һ��װ�ã�����c��dΪʯī�缫���������й��ж���ȷ����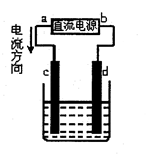
| A��aΪ��Դ���� |
| B��d�缫�ķ�ӦΪ��2Cl����2e��=Cl2�� |
| C���������У�c�缫������������ |
| D���������У���Һ��ͭ����Ũ����С |
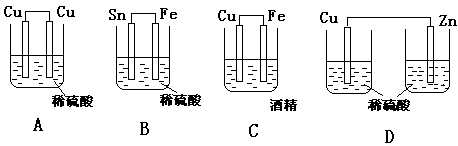
������װ���йص�˵����ȷ����
| A��ͼa�У����ŵ��Ľ�����Һ��H+��Ũ��Խ��Խ�� |
| B��ͼb�У�Mg�缫����صĸ��� |
| C��ͼc�У������ķ�ӦΪCo+Cd2+= Cd+Co2+ |
| D��ͼd�У�K�ֱ���M��N���ӣ�Fe�缫���ܵ��������ḯʴ |