题目内容
以食盐为原料进行生产并综合利用的某些过程如下图所示。
(1)除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂的顺序是(填序号)_____。
A.Na2CO3 B.NaOH C.BaCl2
(2)将滤液的pH调至酸性除去的离子是________。
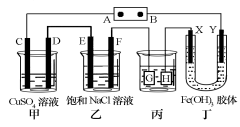
(3)下图表示电解饱和NaCl溶液的装置,X、Y是石墨棒。实验开始时,在两边同时各滴入几滴酚酞溶液,请回答以下问题:X极上的电极反应式是________,在X极附近观察到的现象是________,电解NaCl溶液的离子方程式是_________。
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是________。
(1)C、B、A(或B、C、A);(2)CO32-和OH-;(3)2H++2e-=H2↑有无色气泡产生,溶液变红;2Cl-+2H2O Cl2↑+H2↑+2OH-(4)NH3
Cl2↑+H2↑+2OH-(4)NH3
解析试题分析:(1)首先向溶液中加入NaOH溶液,发生反应:Mg2++2OH-=Mg(OH)2↓除去Mg2+;,然后向溶液中加入BaCl2溶液发生反应:Ba2++SO42-= BaSO4↓,除去SO42-;最后加入Na2CO3 ,发生反应Ca2++ CO32-= CaCO3↓,Ba2++CO32-= BaCO3↓,将原来溶液中的Ca2+及过量的沉淀试剂的Ba2+沉淀除去。加入下列沉淀剂的顺序是B、C、A。也可以是首先向溶液中加入BaCl2溶液发生反应:Ba2++SO42-= BaSO4↓,除去SO42-;然后向溶液中加入NaOH溶液,发生反应:Mg2++2OH-=Mg(OH)2↓除去Mg2+;,最后加入Na2CO3发生反应Ca2++CO32-= CaCO3↓,Ba2++CO32-= BaCO3↓,将原来溶液中的Ca2+及过量的沉淀试剂的Ba2+沉淀除去。加入下列沉淀剂的顺序是C、B、A。
(2)过滤后溶液中含有过量的NaOH、Na2CO3。这时向溶液中加入盐酸,发生反应:H++ OH-= H2O; CO32-+2H+=CO2↑+H2O;因此将滤液的pH调至酸性除去的离子是CO32-和OH-。
(3)在电极食盐水的装置中,与电源正极相连的Y电极为阳极,由于阴离子Cl-、OH-的放电能力Cl->OH-。所以在电极Y上发生的反应为:2Cl—--2e-=Cl2↑; 与电源负极相连的X电极为阴极,由于阳离子H+、Na+的放电能力H+>Na+。所以在电极X上发生的反应为:2H++2e-=H2↑;由于H+不断放电消耗,破坏了附近的水的电离平衡,水会继续电离直至达到新的平衡状态,最终导致附近的溶液中C(OH-)>C(H+),因此滴入几滴酚酞溶液后,在X电极附近溶液变为红色。电解NaCl溶液的离子方程式是2Cl-+2H2O Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
(4)发生反应后的母液中含有大量的NH4Cl,若向分离出NaHCO3晶体后的母液中加入过量生石灰,会发生反应CaO+ H2O= Ca(OH)2,Ca(OH)2+2NH4Cl CaCl2+2NH3↑+ 2H2O。其中可以循环使用的气体是NH3。
CaCl2+2NH3↑+ 2H2O。其中可以循环使用的气体是NH3。
考点:考查粗盐中杂质的除去的方法、步骤及电解食盐水的反应原理、现象和物质的综合利用的知识。

 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案(8分)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。步骤一:电解精制:
请回答以下问题:电解时,阴极上的电极反应式为 ;
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 | 反应 | 平衡常数 |
| 1 | Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O | << 1 |
| 2 | Au3+ + 4Cl— = AuCl4— | >>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因:
(2)滤液含量的测定: 以下是该小组探究滤液的一个实验流程:

则100ml滤液中Fe2+的浓度为 mol·L-1
近年来,为提高能源利用率,西方提出共生理念——为提高经济效益,人类生产活动尽可能多功能化.共生工程将会大大促进化学工业的发展.
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V.实际过程中,将SO2通入电池的 极(填“正”或“负”),负极反应式为 .用这种方法处理SO2废气的优点是 .
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质.合成路线如下:
①生产中,向反应Ⅱ中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是 .
②下列有关说法正确的是 .
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式为CaSO4+4C CaS+4CO↑ CaS+4CO↑ |
| C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的化学方程式 .






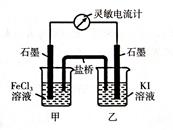
 2Fe2+ + I2设计成如下图所示的原电池
2Fe2+ + I2设计成如下图所示的原电池