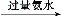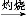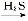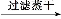题目内容
25 ℃时,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L混合溶液。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
① _________________________;
② _________________________;
③ _________________________。
(2)溶液中共有 种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01 mol·L-1的是 ,浓度为0.002 mol·L-1的是 。
(4) 和 两种粒子物质的量之和等于0.01 mol。
(1)①CH3COO-+H2O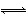 CH3COOH+OH-
CH3COOH+OH-
②CH3COOH CH3COO-+H+
CH3COO-+H+
③H2O H++OH-
H++OH-
(2)7
(3)Na+ Cl-
(4)CH3COOH CH3COO-
【解析】溶液中存在CH3COO-,则有水解平衡:CH3COO-+H2O CH3COOH+OH-;溶液中含有CH3COONa与HCl生成的弱电解质CH3COOH,则有CH3COOH的电离平衡:CH3COOH
CH3COOH+OH-;溶液中含有CH3COONa与HCl生成的弱电解质CH3COOH,则有CH3COOH的电离平衡:CH3COOH CH3COO-+H+;溶液中还存在水的电离平衡:H2O
CH3COO-+H+;溶液中还存在水的电离平衡:H2O H++OH-。溶液中存在的离子有:Cl-、Na+、CH3COO-、H+、OH-,分子有H2O、CH3COOH;能够水解的离子及电离(微弱)产生的离子随外界条件的变化浓度发生变化,故浓度为定值的是强酸、强碱对应的阴、阳离子,即c(Na+)=0.01 mol·L-1,c(Cl-)为0.002 mol·L-1。而由物料守恒c(CH3COO-)+c(CH3COOH)=0.01 mol·L-1,故CH3COO-和CH3COOH的物质的量之和为0.01 mol。
H++OH-。溶液中存在的离子有:Cl-、Na+、CH3COO-、H+、OH-,分子有H2O、CH3COOH;能够水解的离子及电离(微弱)产生的离子随外界条件的变化浓度发生变化,故浓度为定值的是强酸、强碱对应的阴、阳离子,即c(Na+)=0.01 mol·L-1,c(Cl-)为0.002 mol·L-1。而由物料守恒c(CH3COO-)+c(CH3COOH)=0.01 mol·L-1,故CH3COO-和CH3COOH的物质的量之和为0.01 mol。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目