题目内容
(1)航天飞机曾用金属铝粉和高氯酸铵混合物作为固体燃料.加热铝粉使其氧化并放出大量热量,促使混合物中另一种燃料分解.m mol高氯酸铵分解时除产生2m mol水蒸气和m mol氧气外,其他组成元素均以单质形式放出,因而产生巨大的推动力.写出其中涉及到的化学方程式:______ 2Al2O3、2NH4ClO4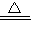 N2↑+4H2O↑+Cl2↑+2O2↑
N2↑+4H2O↑+Cl2↑+2O2↑
【答案】分析:(1)根据铝被氧化则生成氧化铝及高氯酸铵分解时除产生2mmol水蒸气和mmol氧气外,其他组成元素均以单质形式放出,利用质量守恒定律来书写化学反应方程式;
(2)①根据高氯酸铵在高压、450℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气,利用质量守恒定律来书写化学反应方程式;
②利用元素的化合价变化来分析氧化产物与还原产物,然后分析物质的量的关系;再利用氧化还原反应中转移的电子数来计算1mol高氯酸铵分解转移的电子数.
解答:解:(1)因铝与氧气反应生成氧化铝,高氯酸铵分解生成水、氧气及氮气、氯气,由质量守恒定律可知,其反应为
4Al+3O2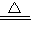 2Al2O3、2NH4ClO4
2Al2O3、2NH4ClO4 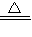 N2↑+4H2O↑+Cl2↑+2O2↑,故答案为:4Al+3O2
N2↑+4H2O↑+Cl2↑+2O2↑,故答案为:4Al+3O2 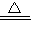 2Al2O3、2NH4ClO4
2Al2O3、2NH4ClO4 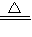 N2↑+4H2O↑+Cl2↑+2O2↑;
N2↑+4H2O↑+Cl2↑+2O2↑;
(2)①由高氯酸铵在高压、450℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气,根据质量守恒定律可知,其反应为4NH4ClO4 6H2O↑+2N2↑+4HCl↑+5O2↑,故答案为:4NH4ClO4
6H2O↑+2N2↑+4HCl↑+5O2↑,故答案为:4NH4ClO4  6H2O↑+2N2↑+4HCl↑+5O2↑;
6H2O↑+2N2↑+4HCl↑+5O2↑;
②在该反应中氮元素、氧元素的化合价升高,氯元素的化合价降低,则氮气和氧气为氧化产物,HCl为还原产物,由方程式可知,氧化产物的物质的量为2+5=7mol,则还原产物的物质的量为4mol,则氧化产物与还原产物的物质的量之比7:4;在该反应中4mol高氯酸铵分解转移的电子数为4×(7-(-1))=32mol,则每分解1mol高氯酸铵转移的电子数目为
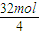 ×NA=8NA=8×6.02×1023,故答案为:7:4;8NA或 8×6.02×1023.
×NA=8NA=8×6.02×1023,故答案为:7:4;8NA或 8×6.02×1023.
点评:本题考查氧化还原反应方程式的书写及转移电子数的计算,明确质量守恒定律及常见元素的化合价是解答本题的关键,并注意信息的正确使用来解答.
(2)①根据高氯酸铵在高压、450℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气,利用质量守恒定律来书写化学反应方程式;
②利用元素的化合价变化来分析氧化产物与还原产物,然后分析物质的量的关系;再利用氧化还原反应中转移的电子数来计算1mol高氯酸铵分解转移的电子数.
解答:解:(1)因铝与氧气反应生成氧化铝,高氯酸铵分解生成水、氧气及氮气、氯气,由质量守恒定律可知,其反应为
4Al+3O2
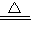 2Al2O3、2NH4ClO4
2Al2O3、2NH4ClO4 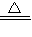 N2↑+4H2O↑+Cl2↑+2O2↑,故答案为:4Al+3O2
N2↑+4H2O↑+Cl2↑+2O2↑,故答案为:4Al+3O2 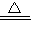 2Al2O3、2NH4ClO4
2Al2O3、2NH4ClO4 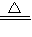 N2↑+4H2O↑+Cl2↑+2O2↑;
N2↑+4H2O↑+Cl2↑+2O2↑;(2)①由高氯酸铵在高压、450℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气,根据质量守恒定律可知,其反应为4NH4ClO4
 6H2O↑+2N2↑+4HCl↑+5O2↑,故答案为:4NH4ClO4
6H2O↑+2N2↑+4HCl↑+5O2↑,故答案为:4NH4ClO4  6H2O↑+2N2↑+4HCl↑+5O2↑;
6H2O↑+2N2↑+4HCl↑+5O2↑;②在该反应中氮元素、氧元素的化合价升高,氯元素的化合价降低,则氮气和氧气为氧化产物,HCl为还原产物,由方程式可知,氧化产物的物质的量为2+5=7mol,则还原产物的物质的量为4mol,则氧化产物与还原产物的物质的量之比7:4;在该反应中4mol高氯酸铵分解转移的电子数为4×(7-(-1))=32mol,则每分解1mol高氯酸铵转移的电子数目为
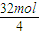 ×NA=8NA=8×6.02×1023,故答案为:7:4;8NA或 8×6.02×1023.
×NA=8NA=8×6.02×1023,故答案为:7:4;8NA或 8×6.02×1023.点评:本题考查氧化还原反应方程式的书写及转移电子数的计算,明确质量守恒定律及常见元素的化合价是解答本题的关键,并注意信息的正确使用来解答.

练习册系列答案
相关题目