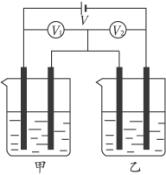
题目内容
甲、乙两烧杯中分别加入等体积等浓度的H2SO4溶液.向甲杯中加入M g镁,向乙杯中加入M g锌.完全反应后,一烧杯中仍有金属未溶解,则甲、乙烧杯中原来H2SO4的物质的量x值是
[ ]
A.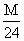 <x<
<x<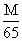
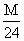 <x<
<x<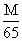
B.x=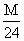
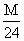
C.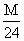 >x≥
>x≥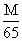
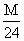 >x≥
>x≥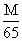
D.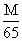 >x≥
>x≥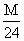
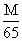 >x≥
>x≥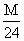
答案:C
解析:
解析:
|
因两烧杯中H2SO4的物质的量相等,由反应方程式可知H2SO4溶解Mg、Zn的物质的量应相等,而等质量的金属中Mg的物质的量大于Zn的物质的量,故一定是Mg剩余,Zn完全溶解,故H2SO4的物质的量应小于Mg的物质的量、大于或等于Zn的物质的量,只有C正确.巧解方法,直接运用数学方法比大值小、比小值大,可知C正确. |

练习册系列答案
相关题目
等体积、等物质的量浓度的盐酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5:7,则甲、乙两烧杯中的反应情况可能分别是( )
| A、甲、乙中都是铝过量 | B、甲中铝过量,乙中碱过量 | C、甲中酸过量,乙中铝过量 | D、甲中酸过量,乙中碱过量 |