题目内容
(16分)在通常状况下,A为固态单质。根据下图转化关系,回答:
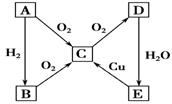
(1)写出A、C、E的化学式:A__________,C__________,E__________。
(2)写出下列反应的化学方程式:
①E―→C :________________________________________________________;
②C―→D :________________________________________________________。
(3)B与E的浓溶液______发生反应(填“能”或“不能”),若能反应,则反应的化学方程式为____ ____,反应现象_________________________。
(1)S SO2 H2SO4
(2)Cu +
2H2SO4 (浓) = CuSO4 + SO2
+ 2H2O 2SO2
+ O2  2SO3
2SO3
(3)能 H2S + H2SO4 = S↓ + SO2↑ + 2H2O 产生淡黄色沉淀及无色有刺激性气味的气体
【解析】固体单质A能和氧气反应,也能和氢气反应,说明是非金属单质。根据其氧化产物可用继续和氧气反应可判断,A是S,和氢气反应生成氯化氢,氯化物燃烧即生成SO2。硫和氧气反应是SO2,SO2和氧气反应生成三氧化硫,三氧化硫溶于水生成硫酸。浓硫酸在加热的条件下和铜发生氧化还原反应,生成硫酸铜、SO2和水。硫化氢中硫元素的化合价是—2价,处于最低价,具有还原性,而浓硫酸具有氧化性,二者发生氧化还原反应,生成硫单质和SO2以及水。

 备战中考寒假系列答案
备战中考寒假系列答案(1)A元素的最高价氧化物的电子式_______。
(2)B元素在周期表中的位置 _______。
(3)B单质与C单质在点燃时反应的生成物中所含化学键类型有______ 。
(4)D元素的低价氧化物与E的单质的水溶液反应的化学方程式为_________________。
(5)C与D能形成2:1的化合物,用电子式表示该化合物的形成过程的 ______。
(6)元素D与元素E相比,非金属性较强的是 _____(用元素符号表示),下列表述中能证明这一事实的是 _______(填选项序号)。
a.常温下D的单质和E的单质状态不同
b.E的氢化物比D的氢化物稳定
c.一定条件下D和E的单质都能与钠反应
d.D的最高价含氧酸酸性弱于E的最高价含氧酸
e.D的单质能与E的氢化物反应生成E单质