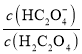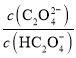题目内容
【题目】根据下列图示所得出的结论正确的是( )
A.图甲表示用0.100mol·L-1AgNO3滴定50.0mL0.0500mol·L-1Cl-溶液的滴定曲线,说明m点时溶液中c(Ag+)与c(Cl-)相等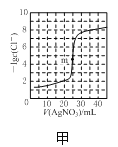
B.图乙表示室温下醋酸溶液中H+浓度与醋酸浓度的关系,说明醋酸浓度越大,醋酸的电离程度越大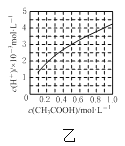
C.图丙是稀释相同体积、相同pH的HNO2和CH3COOH稀溶液时,溶液的pH随加水体积的变化,说明所含溶质的物质的量浓度x点大于y点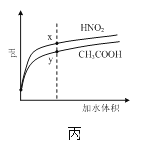
D.图丁是在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率随温度的变化,说明Z点时v(正)<v(逆)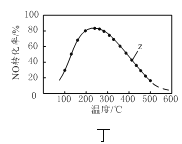
【答案】A
【解析】
A.图甲m点指的是:50.0mL0.0500mol·L-1Cl-溶液和25.0mL 0.100mol·L-1AgNO3二者恰好反应,则c(Ag+)与c(Cl-)相等,A项正确;
B. 图乙表示室温下醋酸溶液中H+浓度与醋酸浓度的关系,说明醋酸浓度越大,溶液酸性越强,但是醋酸的电离程度越小,B项错误;
C.稀释过程中HNO2的变化较大,酸性较强,等pH的二者溶液,HNO2的浓度较小,稀释相同的倍数,得到的HNO2的浓度较小,x点小于y点,C项错误;
D.恒压起始浓度不变,催化剂存在,反应相同时间,升温速率加快,有两种情况。一、温度升高到二百多度,反应达到平衡,继续升温平衡向吸热方向移动,该反应正向放热,故往逆向移动,此时Z点时v(正)<v(逆);二、温度升高,降低了催化剂的活性,速率减慢,还未达到平衡,Z点时v(正)>v(逆);D项错误;
答案选A。

【题目】已知:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O。如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是

选项 | 实验现象 | 结论 |
A | 滴有KSCN的FeCl2溶液变红 | Cl2具有还原性 |
B | 滴有酚酞的NaOH溶液褪色 | Cl2具有酸性 |
C | 紫色石蕊溶液先变红后褪色 | Cl2具有漂白性 |
D | KI淀粉溶液变蓝色 | Cl2具有氧化性 |