题目内容
16.下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )| A. | 0.1 mol•L-1的NH4Cl溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)>c(Cl-) | |
| C. | 已知Ka(HF)=7.2×10-4,Ka(HCN)=6.2×10-10,等体积等浓度的NaF、NaCN溶液中,前者离子总数小于后者 | |
| D. | 浓度均为0.1 mol•L-1的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为:①>②>③ |
分析 A.氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,则c(OH-)<c(H+),结合电荷守恒判断离子浓度大小;
B.将醋酸钠、盐酸两溶液混合后,溶液呈中性,则c(OH-)=c(H+),结合电荷守恒判断c(Na+)、c(Cl-)相对大小;
C.Ka越小,对应盐的水解程度越大,其离子总数就小;
D.①相互促进水解,②中只有铵根离子水解,③中铁离子水解生成的氢离子抑制铵根离子水解.
解答 解:A.铵根离子水解显酸性,则c(H+)>c(OH-),根据电荷守恒得c(Cl-)>c(NH4+),盐类水解较微弱,所以离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),故A错误;
B.溶液呈中性,则c(OH-)=c(H+),结合电荷守恒式c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(Ac-)可知,c(Na+)>c(Cl-),故B正确;
C.Ka越小,对应盐的水解程度越大,由c(Na+)+c(H+)=c(OH-)+c(F-)、c(Na+)+c(H+)=c(OH-)+c(CN-),NaCN溶液c(H+)小,则等体积等浓度的NaF、NaCN溶液中,前者离子总数大于后者,故C错误;
D.①相互促进水解,②中只有铵根离子水解,③中铁离子水解生成的氢离子抑制铵根离子水解,则c(NH4+)的大小顺序为:③>②>①,故D错误;
故选B.
点评 本题考查离子浓度大小的比较,为高频考点,把握盐类水解、水解的促进和抑制及电荷守恒式为解答的关键,选项C为解答的易错点,题目难度中等.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
6.下列实验操作中,正确的是( )
| A. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| B. | 用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| C. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| D. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
7.下列叙述错误的是( )
(1)石油裂解、煤的气化、溶液导电都属于化学变化
(2)H2S水溶液是弱酸,HCl水溶液是强酸,可以验证硫元素的非金属性比氯元素弱
(3)H2O、H2S、H2Se的相对分子质量增大,所以熔沸点依次升高
(4)液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
(5)都是由非金属元素形成的化合物只能是共价化合物.
(1)石油裂解、煤的气化、溶液导电都属于化学变化
(2)H2S水溶液是弱酸,HCl水溶液是强酸,可以验证硫元素的非金属性比氯元素弱
(3)H2O、H2S、H2Se的相对分子质量增大,所以熔沸点依次升高
(4)液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
(5)都是由非金属元素形成的化合物只能是共价化合物.
| A. | 全部 | B. | (2)(3)(4) | C. | (1)(2)(3)(5) | D. | (2)(3)(4)(5) |
11.下列有机物在空气中燃烧的说法正确的是( )
| A. | 只有碳的氧化物和水 | |
| B. | 只有CO2和水 | |
| C. | 可能有碳的氧化物、水及其他元素的化合物 | |
| D. | 有CO、CO2、水及其他元素的化合物 |
5.在一密封容器中盛有0.8mol Na2O2与1mol NaHCO3,将其加热到300℃,经充分反应后,容器内残留的固体是( )
| A. | 0.5mol Na2CO3和1mol NaOH | B. | 1mol Na2CO3和0.6mol NaOH | ||
| C. | 0.8mol Na2CO3和1mol NaOH | D. | 只有1mol Na2CO3 |
 有机物A是常用的食用油抗氧化剂,分子式为C10H12O5,可发生如图转化:已知B的相对分子质量为60,分子中只含一个甲基.C的结构可表示为
有机物A是常用的食用油抗氧化剂,分子式为C10H12O5,可发生如图转化:已知B的相对分子质量为60,分子中只含一个甲基.C的结构可表示为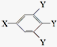 (其中:-X、-Y均为官能团).
(其中:-X、-Y均为官能团).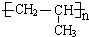 .
.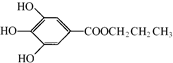 .
.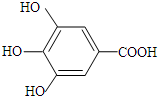 +NaHCO3→
+NaHCO3→ +H2O+CO2↑.
+H2O+CO2↑.