题目内容
工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为:CH2=CH2(g)+H2O(g)?CH3CH2OH(g)△H<0,达到平衡时,要使反应速率加快,同时乙烯的转化率提高,应采取的措施是( )
分析:要使反应速率加快,同时乙烯的转化率提高,方法有升高温度,增大有气体参加的反应的压强等;提高乙烯的转化率,使反应向着正反应方向移动;
A、减小压强,反应速率减小,反应向着逆向移动,乙烯转化率降低;
B、增大压强,反应速率增大,且反应向着正向移动,乙烯转化率升高;
C、分离乙醇,反应向着正向移动,反应速率不变;
D、升高温度,该反应放热,反应向着逆向移动,乙烯的转化率降低.
A、减小压强,反应速率减小,反应向着逆向移动,乙烯转化率降低;
B、增大压强,反应速率增大,且反应向着正向移动,乙烯转化率升高;
C、分离乙醇,反应向着正向移动,反应速率不变;
D、升高温度,该反应放热,反应向着逆向移动,乙烯的转化率降低.
解答:解:A、由于减小压强,根据勒夏特列原理,平衡向着逆向移动,乙烯转化率减小,且反应速率降低,故A错误;
B、由于增大了压强,反应速率增大,化学平衡向着正向移动,乙烯转化率增大,故B正确;
C、分离出乙醇,反应向着正向移动,乙烯转化率增大,但是反应速率不变,故C错误;
D、升高了温度,反应速率增大,但是该反应是放热反应,平衡向着逆向移动,乙烯的转化率减小,故D错误;
故选B.
B、由于增大了压强,反应速率增大,化学平衡向着正向移动,乙烯转化率增大,故B正确;
C、分离出乙醇,反应向着正向移动,乙烯转化率增大,但是反应速率不变,故C错误;
D、升高了温度,反应速率增大,但是该反应是放热反应,平衡向着逆向移动,乙烯的转化率减小,故D错误;
故选B.
点评:本题考查了外界条件对化学平衡及化学反应速率的影响,本题难度中等.

练习册系列答案
相关题目
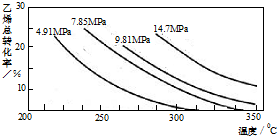 工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为:CH2=CH2(g)+H2O(g)?CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等.下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是( )
工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为:CH2=CH2(g)+H2O(g)?CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等.下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是( )| A、合成乙醇的反应一定为吸热反应 | B、目前工业上采用250~300℃,主要是在此温度下乙烯的转化率最大 | C、目前工业上采用加压条件(7MPa左右),目的是提高乙醇的产率和加快反应速率 | D、相同催化剂下,在300℃14.7MPa乙醇产率反而比300℃7MPa低得多,是因为加压平衡向逆反应方向移动 |
 CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是
CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是
 CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是
CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是