题目内容
根据如图所示装置和操作,回答有关问题。
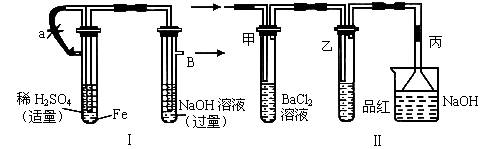
(1)按图Ⅰ所示装置,用两种不同操作分别进行实验,观察B管中现象。
①操作1:先夹紧止水夹a,再使A管开始反应,实验中B管中观察到的现象是_____________________________________。
②操作2:打开止水夹a,使A管反应一段时间后再夹紧止水夹a,实验中在B管中观察到的现象是____________________。
③请说明造成两种操作现象不同的原因(如两种现象相同,此小题不用回答)___________ .
(2)用上述装置的实验结束后,取A管内反应所得的溶液,隔绝空气小心蒸干后,再高温煅烧(有关装置和操作均已略去),最后留下红色固体,将分解时产生的气体按图Ⅱ所示装置依次通过洗气装置,结果试管甲内出现白色沉淀,试管乙内品红溶液红色褪去,回答:
①用方程式表示试管甲产生白色沉淀的原因_________________;
②根据实验现象写出A管内溶液蒸干后,在高温煅烧分解时所发生的化学反应方程式________________________________。
③图Ⅱ中丙装置的作用是__________,实验结束时,在装置丙中观察到的现象是___________________________________。
解析:
(1)①白色沉淀,然后变浅绿色,最后变成红褐色 ②白色沉淀 ③操作1没有排出B试管中的空气,而操作2产生的H2使B中的空气排出 (2)①BaCl2+H2SO4=====BaSO4↓+2HCl SO3+H2O====H2SO4 ②2FeSO4 ③吸收SO2 上升一段水柱
|

(1)在定量实验中,采用下列操作会导致实验结果偏低的是 (填序号)。
A.中和热测定实验中以环形铁丝搅拌棒代替环形玻璃搅拌棒
B.配制100mL 2 mol/L的NaCl溶液,以胶头滴管加水定容时,液面稍超出容量瓶刻度线,反复摇匀后,凹液面最低点恰好与刻度线相切
C.测定硫酸铜晶体结晶水含量,加热并搅拌时,有少量固体溅出。
D.称取一定质量无水碳酸钠粉末,用稀盐酸滴定(用甲基橙作指示剂),测定盐酸浓度。酸式滴定管用蒸馏水润洗后未用待装液润洗,立即装液、滴定。
(2)下列实验操作或实验所得出的结论一定正确的是 (填序号)
A.配制100mL 1.00mol/L的NaCl 溶液时,可用托盘天平准确称取5.85g NaCl
固体
B.某无色溶液中加入盐酸产生无色无味气体且能使澄清石灰水变混浊的气体,则
该溶液中一定含有大量的HCO3-
C.制备Fe(OH)3胶体时,应往沸水中加饱和的FeCl3 溶液,并继续加热到溶液呈
红褐色为止
D.除去蛋白质中混有的少量NaCl,加AgNO3溶液后过滤
E.在中学“硫酸铜晶体里的结晶水含量的测定”实验中,至少需要进行四次称量操
作
F.测定中和热实验中,每次实验均应测量三个温度,即盐酸起始温度,NaOH溶液
的起始温度和反应后溶液的最高温度
(3)根据右图描述回答下列问题:
 |
①关闭图A装置中的止水夹a后,从长颈漏斗向试管中注入一定量的水,静置后如图所示。试判断:A装置是否漏气?(填“漏气”、“不漏气”或“不能确定”)
②关闭图B装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶。试判断:B装置是否漏气?
(填“漏气”、“不漏气”或“不能确定”) ,判断理由是 。



