题目内容
某温度下,把1molN2和3molH2通入一个容积可变的密闭容器里,发生反应:

反应达到平衡状态,测得NH3为smol。若保持温度和压强不变,用m、n、p代表初始加入N2、H2、NH3的物质的量,只改变m、n数值,达到平衡各组分的质量分数不变,请填写表中编号为(1)—(3)各状态空格内的数据。

反应达到平衡状态,测得NH3为smol。若保持温度和压强不变,用m、n、p代表初始加入N2、H2、NH3的物质的量,只改变m、n数值,达到平衡各组分的质量分数不变,请填写表中编号为(1)—(3)各状态空格内的数据。
| 编号 | 初始状态/mol | 平衡状态NH3的物质的量/mol | ||
| N2 | H2 | NH3不变 | ||
| 已知 | 1 | 3 | 0 | s |
| (1) | 0 | 0 | 4 | |
| (2) | | | 0 | 3s |
| (3) | 0.1 | | | 0.25s |
(1)2s (2) 3 9 (3)0.3 0.3
根据等效平衡规律,需要加入的物质(换算成N2、H2)的物质的量比值应符合n(N2)∶n(H2)=1∶3,且与已知的n(N2)、n(H2)成正比。

起始 m n
换算 m+0.5p n+1.5p
(1)m=0、n=0、p=4,得m+0.5p=2,n+1.5p=6,n(N2)、n(H2)为已知的2倍,平衡时,n(NH3)="2s" mol 。
(2)平衡时,n(NH3)=3smol,n(N2)、n(H2)为已知的3倍,即有
m+0.5p=3,n+1.5p=9,p=0代入得m=3,n=9。
(3)平衡时,n(NH3)="0.25s" mol,n(N2)、n(H2)为已知的0.25倍,有m+0.5 p=0.25,n+1.5 p=0.75。m=0.1代入得p=0.3,n=0.3。

起始 m n
换算 m+0.5p n+1.5p
(1)m=0、n=0、p=4,得m+0.5p=2,n+1.5p=6,n(N2)、n(H2)为已知的2倍,平衡时,n(NH3)="2s" mol 。
(2)平衡时,n(NH3)=3smol,n(N2)、n(H2)为已知的3倍,即有
m+0.5p=3,n+1.5p=9,p=0代入得m=3,n=9。
(3)平衡时,n(NH3)="0.25s" mol,n(N2)、n(H2)为已知的0.25倍,有m+0.5 p=0.25,n+1.5 p=0.75。m=0.1代入得p=0.3,n=0.3。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 mZ(g) ΔH="-a" kJ·mol-1(a>0)。现有甲、乙两个容积相等的容器,向甲容器中充入2mol X和1 mol Y,达到平衡时放出热量b kJ;向乙容器中充入1 mol X和0.5 mol Y,达到平衡时放出热量c kJ,且b>2c,则a、b的大小关系及m的值域正确的是( )
mZ(g) ΔH="-a" kJ·mol-1(a>0)。现有甲、乙两个容积相等的容器,向甲容器中充入2mol X和1 mol Y,达到平衡时放出热量b kJ;向乙容器中充入1 mol X和0.5 mol Y,达到平衡时放出热量c kJ,且b>2c,则a、b的大小关系及m的值域正确的是( )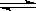 2C(g) 达到平衡时,测得平衡时的物质的量之比为A︰B︰C=2︰2︰1。保持温度不变,再以2︰2︰1的体积比充入A、B和C,则
2C(g) 达到平衡时,测得平衡时的物质的量之比为A︰B︰C=2︰2︰1。保持温度不变,再以2︰2︰1的体积比充入A、B和C,则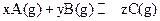 ,平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,测得A的浓度降低为0.30mol/L。下列有关判断正确的是( )
,平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,测得A的浓度降低为0.30mol/L。下列有关判断正确的是( )
 2NH3(g);ΔH<0,在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如右图所示。下列叙述正确的是( )
2NH3(g);ΔH<0,在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如右图所示。下列叙述正确的是( )
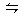 2NH3,并达到平衡,此时N2的转化率为a%,缩小容器的体积,则N2的转化率将( )
2NH3,并达到平衡,此时N2的转化率为a%,缩小容器的体积,则N2的转化率将( )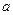 A+
A+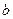 B
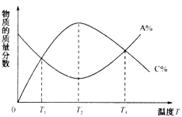
B cC,物质的质量分数A%和C%随温度的变化曲线如图所示,则下列说法正确的是
cC,物质的质量分数A%和C%随温度的变化曲线如图所示,则下列说法正确的是 
 2Fe+3CO2,为更快更好的生产出优质钢材,下列措施不可行的是 ( )
2Fe+3CO2,为更快更好的生产出优质钢材,下列措施不可行的是 ( )