题目内容
11.在标准状况下,将224L氯化氢气体溶于635mL的水(密度为1.00g/cm3)中,所得盐酸的密度为1.18g/cm3.该溶液的物质的量浓度是11.8mol/L.分析 根据n=$\frac{V}{{V}_{m}}$计算HCl物质的量,根据m=nM计算HCl质量,溶液质量=HCl质量+水的质量,根据V=$\frac{m}{ρ}$计算溶液体积,再根据c=$\frac{n}{V}$计算溶液物质的量浓度.
解答 解:标况下224L HCl物质的量为$\frac{224L}{22.4L/mol}$=10mol,HCl质量=10mol×36.5g/mol=265g,溶液质量=365g+635mL×1g/mL=1000g,则溶液体积=$\frac{1000g}{1180g/L}$=$\frac{100}{118}$L,溶液物质的量浓度=$\frac{10mol}{\frac{100}{118}L}$=11.8mol/L,
故答案为:11.8mol/L.
点评 本题考查物质的量浓度计算,难度不大,关键是计算溶液体积,注意对物质的量浓度定义式理解.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
14.A、B、C、D是短周期中原子序数依次增大的元素,其相关信息如下表:
(1)B元素为O(填元素符号),B单质与Na剧烈反应生成的化合物中的化学键类型是离子键、共价键.
(2)C元素的单质与水反应可产生使带余烬的木条复燃的气体,该反应的化学方程式为2F2+2H2O=4HF+O2.
(3)由A、D两种元素组成的-种化合物X分子中,所有原子的最外层均达到8电子稳定结构,则X的电子式为 .X常用作漂白剂,也用于柠檬等水果的熏蒸处理.已知化合物X中,A显负价,D显正价,则该化合物与水反应的化学方程式为NCl3+4H2O=NH3.H2O+3HClO.
.X常用作漂白剂,也用于柠檬等水果的熏蒸处理.已知化合物X中,A显负价,D显正价,则该化合物与水反应的化学方程式为NCl3+4H2O=NH3.H2O+3HClO.
| 元素 | 相关信息 |
| A | 简单氢化物能与其最高价含氧酸反应生成盐 |
| B | 原子最外层电子数是其电子层数的3倍 |
| C | 周期表中非金属性最强的元素 |
| D | 与C位于同主族,且都为短周期元素 |
(2)C元素的单质与水反应可产生使带余烬的木条复燃的气体,该反应的化学方程式为2F2+2H2O=4HF+O2.
(3)由A、D两种元素组成的-种化合物X分子中,所有原子的最外层均达到8电子稳定结构,则X的电子式为
 .X常用作漂白剂,也用于柠檬等水果的熏蒸处理.已知化合物X中,A显负价,D显正价,则该化合物与水反应的化学方程式为NCl3+4H2O=NH3.H2O+3HClO.
.X常用作漂白剂,也用于柠檬等水果的熏蒸处理.已知化合物X中,A显负价,D显正价,则该化合物与水反应的化学方程式为NCl3+4H2O=NH3.H2O+3HClO.
2.在密闭容器中将CO和水蒸气的混合物加热到800℃时,有下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g),且K=1.若用2molCO和2mol H2O相互混合并加热到800℃,则CO的转化率为( )
| A. | 16.7% | B. | 50% | C. | 66.7% | D. | 83.3% |
19.下列检验某溶液中是否含有SO42-的方法中正确的是( )
| A. | 向该溶液中加入酸化的Ba(NO3)2溶液出现白色沉淀,说明溶液中一定有SO42- | |
| B. | 向该溶液中加入BaCl2溶液出现白色沉淀,说明该溶液中一定有SO42- | |
| C. | 向该溶液中加入足量HCl,无现象,再加入BaCl2溶液出现白色沉淀,说明该溶液中一定有SO42- | |
| D. | 向该溶液中加入BaCl2溶液,产生白色沉淀,再加入HCl沉淀不溶解,说明该溶液中一定有SO42- |
6.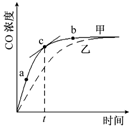 已知反应Al2O3(s)+3C(s)+N2(g)?2AlN(s)+3CO(g)在温度、容积恒定的密闭容器中进行,其中CO浓度随时间的变化关系如图曲线甲所示.下列说法不正确的是( )
已知反应Al2O3(s)+3C(s)+N2(g)?2AlN(s)+3CO(g)在温度、容积恒定的密闭容器中进行,其中CO浓度随时间的变化关系如图曲线甲所示.下列说法不正确的是( )
 已知反应Al2O3(s)+3C(s)+N2(g)?2AlN(s)+3CO(g)在温度、容积恒定的密闭容器中进行,其中CO浓度随时间的变化关系如图曲线甲所示.下列说法不正确的是( )
已知反应Al2O3(s)+3C(s)+N2(g)?2AlN(s)+3CO(g)在温度、容积恒定的密闭容器中进行,其中CO浓度随时间的变化关系如图曲线甲所示.下列说法不正确的是( )| A. | 从a、b两点坐标可求得从a到b时间间隔内该化学反应的平均速率 | |
| B. | c点切线的斜率表示该化学反应在t时刻的瞬时速率 | |
| C. | 在不同时刻都存在关系:3v(N2)=v(CO) | |
| D. | 维持温度、容积不变,若减少N2的物质的量进行反应,曲线甲将转变为曲线乙 |
16.和下列离子反应方程式相对应的化学方程式正确的是( )
| A. | Zn2++2OH-=Zn(OH)2↓ ZnCO3+2NaOH=Zn(OH)2↓+Na2CO3 | |
| B. | Ba2++SO42-=BaSO4↓ Ba(OH)2+H2SO4=BaSO↓+2H2O | |
| C. | Ag++Cl-=AgCl↓ AgNO3+NaCl=AgCl↓+NaNO3 | |
| D. | Cu+2Ag+=Cu2++2Ag↓ Cu+2AgCl=2Ag+CuCl2 |
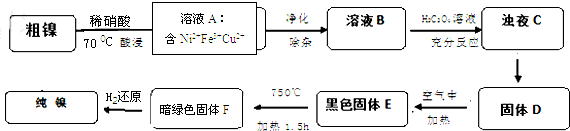
3.镍是重要的有色金属之一,但粗镍中一般含有Fe、Cu及难与酸、碱溶液反应的不溶性杂质而影响使用.现对粗镍进行提纯,具体的反应流程如下:
已知:
①2Ni2O3(黑色)$\frac{\underline{\;750℃\;}}{\;}$4NiO(黑色)+O2↑
②
根据信息回答:
(1)28Ni在周期表中的第四周期;镍与稀硝酸反应的离子方程式为3Ni+8H++2NO3-=3Ni2++2NO↑+4H2O.实验表明镍的浸出率与温度有关,随着温度升高镍的浸出率增大,但当温度高于70℃时,镍的浸出率又降低,浸出渣中Ni(OH)2含量增大,其原因为温度升高时,Ni2+的水解程度变大;
(2)在溶液A的净化除杂中,先调节PH=5.5,加热煮沸5min,静置一段时间后,过滤出Fe(OH)3.为了得到纯净的溶液B还需要加入以下物质C进行除杂(填正确答案标号).
A、NaOH B、Na2S C、H2S D、NH3﹒H2O
(3)已知以下三种物质的溶解度关系:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O.由浊液C得到固体D的操作包括过滤、洗涤、干燥(填操作名称); D生成E的化学方程式为4NiC2O4•2H2O+3 O2=2Ni2O3+8CO2↑+8H2O.
(4)1molE经上述流程得到纯镍,理论上参加反应的氢气为2 mol.
(5)测定样品中的镍含量的基本思路是将Ni2+转化为沉淀,通过测量沉淀的质量进一步推算Ni含量.已知Ni2+能与CO32-,C2O42-、S2-等离子形成沉淀,但测定时常选用丁二酮肟(C4H8N2O2)作沉淀剂,生成分子式为C8H14N4O4Ni的鲜红色沉淀.从实验误差角度分析主要原因为:生成沉淀质量大,称量误差小,分析结果准确度高.

已知:
①2Ni2O3(黑色)$\frac{\underline{\;750℃\;}}{\;}$4NiO(黑色)+O2↑
②
| 物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS |
| Ksp | 8.8×10-38 | 2.2×10-20 | 5.48×10-18 | 3.2×1018 |
(1)28Ni在周期表中的第四周期;镍与稀硝酸反应的离子方程式为3Ni+8H++2NO3-=3Ni2++2NO↑+4H2O.实验表明镍的浸出率与温度有关,随着温度升高镍的浸出率增大,但当温度高于70℃时,镍的浸出率又降低,浸出渣中Ni(OH)2含量增大,其原因为温度升高时,Ni2+的水解程度变大;
(2)在溶液A的净化除杂中,先调节PH=5.5,加热煮沸5min,静置一段时间后,过滤出Fe(OH)3.为了得到纯净的溶液B还需要加入以下物质C进行除杂(填正确答案标号).
A、NaOH B、Na2S C、H2S D、NH3﹒H2O
(3)已知以下三种物质的溶解度关系:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O.由浊液C得到固体D的操作包括过滤、洗涤、干燥(填操作名称); D生成E的化学方程式为4NiC2O4•2H2O+3 O2=2Ni2O3+8CO2↑+8H2O.
(4)1molE经上述流程得到纯镍,理论上参加反应的氢气为2 mol.
(5)测定样品中的镍含量的基本思路是将Ni2+转化为沉淀,通过测量沉淀的质量进一步推算Ni含量.已知Ni2+能与CO32-,C2O42-、S2-等离子形成沉淀,但测定时常选用丁二酮肟(C4H8N2O2)作沉淀剂,生成分子式为C8H14N4O4Ni的鲜红色沉淀.从实验误差角度分析主要原因为:生成沉淀质量大,称量误差小,分析结果准确度高.
20.下列离子方程式中正确的是( )
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 锌与盐酸的反应:Zn+2H++2Cl-═Zn2++2Cl-+H2↑ | |
| D. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ |