题目内容
下列叙述不正确的是( )
分析:A、某些强酸的酸式盐和强酸弱碱盐的溶液的pH也小于7;
B、根据沉淀转化原理分析;
C、已知H2A=H++HA-,说明溶液中没有H2A分子存在;
D、根据pH=-lg[H+]分析.
B、根据沉淀转化原理分析;
C、已知H2A=H++HA-,说明溶液中没有H2A分子存在;
D、根据pH=-lg[H+]分析.
解答:解:A、某些强酸的酸式盐和强酸弱碱盐的溶液的pH也小于7,如硫酸氢钠溶液显酸性,氯化铵溶液显酸性,即pH<7,所以某物质的溶液pH<7,则该物质不一定是酸的溶液,故A正确;
B、根据沉淀转化原理:一般溶度积大的沉淀转化为溶度积小的沉淀容易实现,氢氧化铁的溶度积远小于氢氧化镁的溶度积,所以往Mg(OH)2的悬浊溶液中滴加0.1mol/L的FeC13溶液,有红褐色的氢氧化铁生成,故B正确;
C、已知H2A=H++HA-,则H2A的第一步电离为完全电离,所以溶液中没有H2A分子存在,因此NaHA溶液中没有H2A分子存在,则溶液中c(Na+)=+c(A2-)+c(HA-),
故C错误;
D、已知pH=-lg[H+],已知P点为反应终点,溶液中的氢离子浓度等于水电离的氢离子与酸电离的氢离子之和,则P点时pH=-lg[
+c(H+)],故D正确.
故选BD.
B、根据沉淀转化原理:一般溶度积大的沉淀转化为溶度积小的沉淀容易实现,氢氧化铁的溶度积远小于氢氧化镁的溶度积,所以往Mg(OH)2的悬浊溶液中滴加0.1mol/L的FeC13溶液,有红褐色的氢氧化铁生成,故B正确;
C、已知H2A=H++HA-,则H2A的第一步电离为完全电离,所以溶液中没有H2A分子存在,因此NaHA溶液中没有H2A分子存在,则溶液中c(Na+)=+c(A2-)+c(HA-),
故C错误;
D、已知pH=-lg[H+],已知P点为反应终点,溶液中的氢离子浓度等于水电离的氢离子与酸电离的氢离子之和,则P点时pH=-lg[
| Kw |
故选BD.
点评:本题考查了溶液酸碱性的判断,沉淀的转化,弱电解质的电离和盐的水解,pH的有关计算等,侧重于反应原理的应用的考查,题目难度中等.

练习册系列答案
相关题目
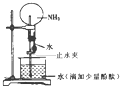 如图是实验室进行氨溶于水的“喷泉实验”的装置,下列叙述不正确的是( )
如图是实验室进行氨溶于水的“喷泉实验”的装置,下列叙述不正确的是( )| A、该实验说明氨气是一种极易溶于水的气体 | B、进入烧瓶中的液体颜色由无色变为红色,说明氨水有碱性 | C、氨水很稳定,将烧瓶中的红色溶液加热,颜色不会发生变化 | D、形成“喷泉”的主要原因是氨气溶于水后,烧瓶内的气压小于大气压 |
苯与乙烯相比较,下列叙述不正确的是( )
| A、都能燃烧,生成二氧化碳和水 | B、都容易发生加成反应 | C、乙烯易发生加成反应,苯只能在特殊条件下才发生加成反应 | D、乙烯易被酸性高锰酸钾溶液氧化,苯不能被酸性高锰酸钾溶液氧化 |