题目内容
下图是元素周期表的前四周期的结构,请回答| A | |||||||||||||||||
| B | C | D | |||||||||||||||
| E | F | G | |||||||||||||||
| H | |||||||||||||||||
(2)请写出C元素单质的结构式______
(3)E、D两种元素可形成一种原子个数比为1:1的化合物M,请写出M的电子式______,指出化合物M中的化学键类型______.
(4)E、F、G三种元素的最高价氧化物对应的水化物可以两两反应,请写出反应的离子方程式:
E+F______
E+G______
F+G______
(5)H的一种氢氧化物不稳定,很容易被氧气氧化,请写出该反应的化学方程式:______.
解答:解:(1)A位于元素周期表第一周期ⅠA族,为H元素;B位于第二周期ⅣA族,为C元素;C位于第二周期ⅤA族,为N元素;D位于第二周期ⅥA族,为O元素,故答案为:H、C、N、O;
(2)C为N元素,形成的单质为N2,N原子之间有三个共用电子对,结构式为:N≡N,故答案为:N≡N;
(3)D为O元素,E为Na元素,两种元素可形成一种原子个数比为1:1的化合物为Na2O2,为离子化合物,电子式为
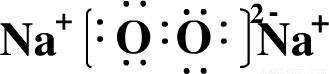 ,化合物中含有离子键和共价键,故答案为:
,化合物中含有离子键和共价键,故答案为: ,离子键、共价键;
,离子键、共价键;(4)E、F、G三种元素的最高价氧化物对应的水化物分别为:NaOH、Al(OH)3和HClO4,其中具有两性,既能和酸反应生成盐和水,又能和碱反应生成盐和水,反应的离子方程式分别为:3H++Al(OH)3=Al3++3H2O、OH-+Al(OH)3=AlO2-+2H2O;NaOH和HClO4,都是强电解质,二者反应的离子方程式为OH-+H+=H2O,
故答案为:OH-+Al(OH)3=AlO2-+2H2O;OH-+H+=H2O;3H++Al(OH)3=Al3++3H2O;
(5)H 位于第四周期第Ⅷ族,为Fe元素,对应的氢氧化物中Fe(OH)2不稳定,具有还原性,很容易被氧气氧化生成Fe(OH)3,反应的化学方程式为4Fe(OH)2+2H2O+O2=4Fe(OH)3,
故答案为:4Fe(OH)2+2H2O+O2=4Fe(OH)3.
点评:本题考查元素周期表及元素、单质、化合物的性质,题目难度中等,本题注意把握Fe的位置及对应化合物的性质.

(16分)下图是元素周期表的前四周期的结构,请回答
| A |
|
| |||||||||||||||
|
|
|
|
| B | C | D |
|
| |||||||||
| E |
| F |
|
|
| G |
| ||||||||||
|
|
|
|
|
|
|
| H |
|
|
|
|
|
|
|
|
|
|
⑴请写出各元素的元素符号:A 、B 、C 、D 、
⑵请写出C元素单质的结构式
⑶E、D两种元素可形成一种原子个数比为1:1的化合物M,请写出M的电子式 ,指出化合物M中的化学键类型 。
⑷E、F、G三种元素的最高价氧化物对应的水化物可以两两反应,请写出反应的离子方程式:
E+F
E+G
F+G www.7caiedu.cn
⑸H的一种氢氧化物不稳定,很容易被氧气氧化,请写出该反应的化学方程式:
(16分)下图是元素周期表的前四周期的结构,请回答
| A | | | |||||||||||||||
| | | | | B | C | D | | | |||||||||
| E | | F | | | | G | | ||||||||||
| | | | | | | | H | | | | | | | | | | |
⑴请写出各元素的元素符号:A 、B 、C 、D 、
⑵请写出C元素单质的结构式
⑶E、D两种元素可形成一种原子个数比为1:1的化合物M,请写出M的电子式 ,指出化合物M中的化学键类型 。
⑷E、F、G三种元素的最高价氧化物对应的水化物可以两两反应,请写出反应的离子方程式:
E+F
E+G
F+G www.ks5u.com
⑸H的一种氢氧化物不稳定,很容易被氧气氧化,请写出该反应的化学方程式:
(16分)下图是元素周期表的前四周期的结构,请回答
|
A |
|
|
|||||||||||||||
|
|
|
|
|
B |
C |
D |
|
|
|||||||||
|
E |
|
F |
|
|
|
G |
|
||||||||||
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
⑴请写出各元素的元素符号:A 、B 、C 、D 、
⑵请写出C元素单质的结构式
⑶E、D两种元素可形成一种原子个数比为1:1的化合物M,请写出M的电子式 ,指出化合物M中的化学键类型 。
⑷E、F、G三种元素的最高价氧化物对应的水化物可以两两反应,请写出反应的离子方程式:
E+F
E+G
F+G www.7caiedu.cn
⑸H的一种氢氧化物不稳定,很容易被氧气氧化,请写出该反应的化学方程式:
