题目内容
某短周期元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:甲+乙 丙+丁+水.
丙+丁+水.
(1)若丙为NO2.甲与乙反应的化学方程式为______.
(2)若丙为SO2.
①把乙滴入硫酸铜晶体,观察到的现象是______.
②SO2能使酸性KMnO4溶液紫红色褪去,完成下列离子方程式:______MnO4-+______SO2+______H2O=______Mn2++______SO42-+______H+.
解:短周期元素的原子最外层电子数为次外层的2倍,则为C元素,
(1)丙为NO2,则发生C与浓硝酸的反应,该反应为C+4HNO3(浓) CO2↑+4NO2↑+2H2O,故答案为:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O,故答案为:C+4HNO3(浓) CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
(2)若丙为SO2,发生C与浓硫酸的反应,则乙为浓硫酸,
①把乙滴入硫酸铜晶体,浓硫酸具有吸水性,观察到蓝色变为白色,故答案为:蓝色变为白色;
②SO2能使酸性KMnO4溶液紫红色褪去,发生氧化还原反应,该离子反应为2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,故答案为:2;5;2;2;5;4.
分析:短周期元素的原子最外层电子数为次外层的2倍,则为C元素,
(1)发生C与浓硝酸的反应;
(2)发生C与浓硫酸的反应,浓硫酸具有吸水性,SO2能使酸性KMnO4溶液紫红色褪去,发生氧化还原反应,以此来解答.
点评:本题考查二氧化硫的化学性质及C与浓硫酸、浓硝酸的反应,明确C元素的推断是解答的突破口,注意物质的性质与发生的化学反应即可解答,题目难度不大.
(1)丙为NO2,则发生C与浓硝酸的反应,该反应为C+4HNO3(浓)
 CO2↑+4NO2↑+2H2O,故答案为:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O,故答案为:C+4HNO3(浓) CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;(2)若丙为SO2,发生C与浓硫酸的反应,则乙为浓硫酸,
①把乙滴入硫酸铜晶体,浓硫酸具有吸水性,观察到蓝色变为白色,故答案为:蓝色变为白色;
②SO2能使酸性KMnO4溶液紫红色褪去,发生氧化还原反应,该离子反应为2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,故答案为:2;5;2;2;5;4.
分析:短周期元素的原子最外层电子数为次外层的2倍,则为C元素,
(1)发生C与浓硝酸的反应;
(2)发生C与浓硫酸的反应,浓硫酸具有吸水性,SO2能使酸性KMnO4溶液紫红色褪去,发生氧化还原反应,以此来解答.
点评:本题考查二氧化硫的化学性质及C与浓硫酸、浓硝酸的反应,明确C元素的推断是解答的突破口,注意物质的性质与发生的化学反应即可解答,题目难度不大.

练习册系列答案
相关题目
(14分)某短周期元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:
甲 + 乙 丙 + 丁 + 水。
丙 + 丁 + 水。
(1)若丙为NO2。
①甲与乙反应的化学方程式为 。
②火箭常用NO2的二聚体N2O4作氧化剂,肼(N2H4)作燃料,已知:
N2(g)+2O2(g)=2NO2(g) △H =-67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H =-534.0kJ·mol-1
2NO2(g) N2O4(g) △H =-52.7kJ·mol-1
N2O4(g) △H =-52.7kJ·mol-1
试写出气态肼(N2H4)在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
___________________________________________________。
③肼又称联氨,广泛用于火箭推进剂、有机合成及燃料电池。肼燃料电池原理如右图所示,右边电极为 (填“正极”、“负极”),左边电极上发生的电极反应式为 。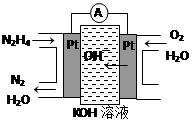
(2)若丙为SO2。
①把乙滴入硫酸铜晶体中,观察到的现象是 。
②SO2气体有毒,多余的SO2气体常用足量的NaOH溶液吸收,写出吸收液中离子浓度由大到小的顺序: 。
③在氧化还原反应的过程中,氧化反应和还原反应同时发生,有关反应:
SO2-2e-+2H2O = SO42-+4H+反应的说法错误的是 。
| A.该反应为氧化反应 |
| B.上述反应中若转移电子物质的量为0.05mol,则生成溶液的PH值为1 |
| C.Fe2(SO4)3、品红两种溶液都能使上述反应进行 |
| D.通入Cl2会降低SO2的漂白作用 |
 丙+丁+水。
丙+丁+水。 。
。 。
。 MnO4- +
MnO4- +  2SO3(g) △H< 0反应。该反应的化学平衡常数K= (填表达式);反应达平衡时,若改变其中一个条件x,则符合图中曲线的是 (填序号)。
2SO3(g) △H< 0反应。该反应的化学平衡常数K= (填表达式);反应达平衡时,若改变其中一个条件x,则符合图中曲线的是 (填序号)。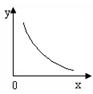
 丙 + 丁 + 水。
丙 + 丁 + 水。 N2O4(g)
△H =-52.7kJ·mol-1
N2O4(g)
△H =-52.7kJ·mol-1