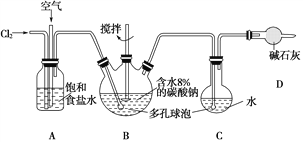
题目内容
【题目】某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液.在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成 ClO2气体的纯度,且会影响ClO2的吸收率,具体情况如图所示.
(1)据图可知,反应时需要控制的适宜温度是℃,要达到此要求需要采取的措施是 .
(2)已知:黄铁矿中的硫元素在酸性条件下可被ClO3﹣氧化成SO42﹣ , 请写出制备二氧化氯(ClO2)的离子方程式: .
(3)该校化学学习小组拟以“ ![]() ”作为衡量ClO2产率的指标.若取NaClO3样品6.0g,通过反应和吸收获得400mL ClO2溶液,取此溶液20mL与37.00mL 0.500molL﹣1 (NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.050 0molL﹣1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00mL.反应原理为: 4H++ClO2+5Fe2+═Cl﹣+5Fe3++2H2O
”作为衡量ClO2产率的指标.若取NaClO3样品6.0g,通过反应和吸收获得400mL ClO2溶液,取此溶液20mL与37.00mL 0.500molL﹣1 (NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.050 0molL﹣1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00mL.反应原理为: 4H++ClO2+5Fe2+═Cl﹣+5Fe3++2H2O
14H++Cr2O72﹣+6Fe2+═2Cr3++6Fe3++7H2O
试计算ClO2的“产率”(写出计算过程).
【答案】
(1)30℃;水浴加热
(2)15ClO3﹣+FeS2+14H+═15ClO2+Fe3++7H2O+2SO42﹣
(3)56.25%
【解析】解:(1)ClO2气体的纯度,且会影响ClO2的吸收率,依据图象分析温度再30°C时ClO2的吸收率最大纯度90%以上,控制100°C以下的 温度需要用水浴加热;
故答案为:30℃;水浴加热;(2)用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,氯酸跟离子在酸溶液中具有强氧化性,氧化FeS2为硫酸铁和硫酸,本身被还原为反应的离子方程式为ClO2;结合原子守恒、电子守恒配平写出离子方程式为:15ClO3﹣+FeS2+14H+═15ClO2+Fe3++7H2O+2SO42﹣;
答案为:15ClO3﹣+FeS2+14H+═15ClO2+Fe3++7H2O+2SO42﹣;(3)依据题干离子反应过程得到
Cr2O72﹣~~~~~~~ | 6Fe2+ |
1 | 6 |
0.050 0molL﹣1×0.020L | 0.006mol |
ClO2~~~~~ | 5Fe2+ |
1 | 5 |
0.0025mol | 0.037L×0.500molL﹣1﹣0.006mol |
400mL ClO2溶液中含ClO2 0.0025mol×20=0.05mol;
以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标,所以产率= ![]() ×100%=56.25%
×100%=56.25%
故答案为:56.25%
(1)依据图象分析温度再30°C时ClO2的吸收率最大纯度90%以上;控制100°C以下的 温度需要用水浴加热;(2)用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,依据原子守恒,电子守恒和电荷守恒配平书写离子方程式;(3)依据化学方程式的定量关系列式计算,以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标;

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案【题目】某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①称取2 gCuSO4·5H2O研细后倒入烧杯,加10 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题:
(1)步骤①、③中研磨固体所用仪器的名称是__________________。
(2)步骤③中洗涤沉淀的操作是____________________________________。
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较用图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
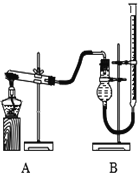
实验序号 | KClO3质量 | 其它物质质量 | 待测数据 |
④ | 1.2g | 无其他物质 | |
⑤ | 1.2g | CuO 0.5g | |
⑥ | 1.2g | MnO2 0.5g |
回答下列问题:
(3)上述实验中的“待测数据”指__________________。
(4)若要证明实验⑤中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞,____________________________________。
(5)为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):a、_________________________________;b、CuO的化学性质有没有改变。