题目内容
T℃时在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论正确的是 
A.反应进行的前3 min内,用X表示的反应速率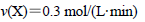 |
| B.平衡时容器内的压强为反应前的0.9倍 |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K减小 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
B
解析试题分析:A、v= =
=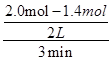 =0.1mol/(L.min),故A错误;B、密闭容器内气体压强的比为物质的量的比,即反应前X为2.0mol,Y为1.6mol,Z为0.4mol,平衡时X为1.4mol,Y为1.4mol,Z为0.8mol,反应前后气压比=反应前后物质的量比=2+1.6+0.4:1.4+1.4+0.8=10:9,故B正确;C、由图2知,“先拐平数值大”,所以T2>T1,升高温度Y的转化率减少,平衡向逆反应方向移动,所以升高温度平衡常数减小,故C错误;D、图3与图1比较,图3到达平衡所用的时间较短,说明反应速率增大,但平衡状态没有发生改变,该反应正反应是气体物质的量减小的反应,故应是加入催化剂所致,故D错误;
=0.1mol/(L.min),故A错误;B、密闭容器内气体压强的比为物质的量的比,即反应前X为2.0mol,Y为1.6mol,Z为0.4mol,平衡时X为1.4mol,Y为1.4mol,Z为0.8mol,反应前后气压比=反应前后物质的量比=2+1.6+0.4:1.4+1.4+0.8=10:9,故B正确;C、由图2知,“先拐平数值大”,所以T2>T1,升高温度Y的转化率减少,平衡向逆反应方向移动,所以升高温度平衡常数减小,故C错误;D、图3与图1比较,图3到达平衡所用的时间较短,说明反应速率增大,但平衡状态没有发生改变,该反应正反应是气体物质的量减小的反应,故应是加入催化剂所致,故D错误;
考点:物质的量或浓度随时间的变化曲线;转化率随温度、压强的变化曲线

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案一定温度下,某密闭容器中发生反应:2HI(g) H2(g)+I2(g) △H>0,若15s内c(HI)由0.1 mol·L-1降到0.07 mol·L-1,则下列说法正确的是
H2(g)+I2(g) △H>0,若15s内c(HI)由0.1 mol·L-1降到0.07 mol·L-1,则下列说法正确的是
| A.15s内用H2表示的平均反应速率为v(H2)="0.002" mol·L-1·s-1 |
| B.升高温度平衡逆向移动 |
| C.c(HI)由0.07 mol·L-1降到0.05 mol·L-1所需时间为10s |
| D.减小反应体系的体积,化学反应速率加快 |
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )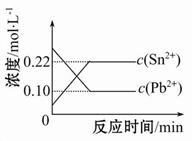
| A.往平衡体系中加入少量金属铅后,c(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0 |
| D.25℃时,该反应的平衡常数K=2.2 |
氨的催化氧化过程主要有以下两个反应:
(ⅰ)4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-905.5 kJ·mol-1
4NO(g)+6H2O(g) ΔH=-905.5 kJ·mol-1
(ⅱ)4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH=-1267 kJ·mol-1
2N2(g)+6H2O(g) ΔH=-1267 kJ·mol-1
测得温度对NO、N2产率的影响如图所示。下列说法错误的是( )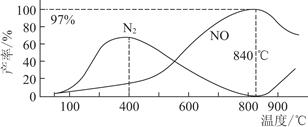
| A.升高温度,反应(ⅰ)和(ⅱ)的平衡常数均减小 |
| B.840 ℃后升高温度,反应(ⅰ)的正反应速率减小,反应(ⅱ)的正反应速率增大 |
| C.900 ℃后,NO产率下降的主要原因是反应(ⅰ)平衡逆向移动 |
| D.800 ℃左右时,氨的催化氧化主要按照(ⅰ)进行 |
一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
| A.容器Ⅰ、Ⅱ中正反应速率相同 |
| B.容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C.容器Ⅰ中CO的物质的量比容器Ⅱ中的多 |
| D.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1 |
在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) Ni(CO)4(g),已知该反应在25 ℃和80 ℃时的平衡常数分别为5×104、2,下列说法正确的是( )。
Ni(CO)4(g),已知该反应在25 ℃和80 ℃时的平衡常数分别为5×104、2,下列说法正确的是( )。
| A.上述生成Ni(CO)4(g)的反应为吸热反应 |
| B.在80 ℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v(正)<v(逆) |
| C.恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 |
| D.恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,Ni(CO)4的百分含量将增大 |
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g) 2CO2(g)+S(l) ΔH<0
2CO2(g)+S(l) ΔH<0
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
| A.平衡前,随着反应的进行,容器内压强始终不变 |
| B.平衡时,其他条件不变,分离出硫,正反应速率加快 |
| C.平衡时,其他条件不变,升高温度可提高SO2的转化率 |
| D.其他条件不变,使用不同催化剂,该反应的平衡常数不变 |
一定条件下,向容积为2 L的密闭容器中充入1 mol CO2和3 mol H2,发生如下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),5 min后反应达到平衡时c(CH3OH)为0.2 mol·L-1。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是( )。
CH3OH(g)+H2O(g),5 min后反应达到平衡时c(CH3OH)为0.2 mol·L-1。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是( )。
| A.0~5 min,CO2的平均反应速率为0.04 mol·(L·min)-1 |
B.反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)的ΔH<0 CH3OH(g)+H2O(g)的ΔH<0 |
| C.在T2℃时,若反应处于状态D,则一定有v正<v逆 |
| D.若T1℃、T2℃时的平衡常数分别为K1、K2,则K1>K2 |
下列叙述中能判断某化学平衡发生移动的是( )
| A.混合物中各组分的浓度改变 |
| B.正、逆反应速率改变 |
| C.混合物中各组分的含量改变 |
| D.混合体系的压强发生改变 |