题目内容
16.将224mL标准状况下的甲烷和氧气的混合气体点燃,完全燃烧后,将生成的气体通入100mL0.02mol/L的石灰水中,得到0.1g白色沉淀.求原混合气体中甲烷和氧气的体积比1:9或3:7.(只要求写出结果)分析 甲烷燃烧生成二氧化碳和水,二氧化碳和氢氧化钙反应生成碳酸钙白色沉淀,碳酸钙和二氧化碳、水反应生成碳酸氢钙,分情况讨论,当二氧化碳不足量时,结合碳原子守恒根据碳酸钙的量计算甲烷的量,从而得出甲烷和氧气的体积比;当二氧化碳过量时,根据钙元素守恒计算二氧化碳的量,再结合碳原子守恒计算甲烷的量,从而得出甲烷和氧气的体积比.
解答 解:混合气体的物质的量为:$\frac{0.224L}{22.4L/mol}$=0.01mol,
反应的化学方程式:CH4+2O2=CO2+2H2O、CO2+Ca(OH)2=CaCO3↓+H2O、CaCO3+CO2+H2O═Ca(HCO3)2,
根据方程式知,白色沉淀是碳酸钙,碳酸钙的物质的量为:$\frac{0.1g}{100g/mol}$=0.001mol,
氢氧化钙的物质的量为:0.02mol/L×0.1L=0.002mol,
当生成的CO2刚好为0.001mol时,根据碳原子守恒知,n(CaCO3)=n(CH4)=0.001mol,则氧气的物质的量是0.009mol,则甲烷与氧气的体积比为1:9;
当生成的CO2过量时,n(CaCO3)=0.001mol,根据钙原子守恒知,n(Ca(HCO3)2)=0.001mol,
根据碳原子守恒得,n(CH4)=n(CO2)=0.001mol+0.002mol=0.003mol,则氧气的物质的量为0.007mol,所以甲烷与氧气的体积比为3:7,
故答案为:1:9或3:7.
点评 本题考查了混合物反应的计算,题目难度中等,正确判断反应物过量情况对生成物的影响为解答关键,注意掌握讨论法在化学计算中的应用,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案
相关题目
9.为提纯下列物质(括号内的物质是杂质),所选用的除杂实际和分离方法都正确的是( )
| 被提纯的物质 | 除杂试剂 | 分离方法 | |
| A | SO2(乙炔) | 溴水 | 洗气 |
| B | 苯(溴) | KI溶液 | 分液 |
| C | 乙醇(乙酸) | 饱和Na2CO3溶液 | 蒸馏 |
| D | 乙烷(乙烯) | KMnO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
7.有机物丁香油酚的结构式为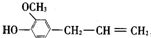 ,按官能团分类,它不属于( )
,按官能团分类,它不属于( )
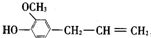 ,按官能团分类,它不属于( )
,按官能团分类,它不属于( )| A. | 烯类 | B. | 酚类 | C. | 醚类 | D. | 醇类 |
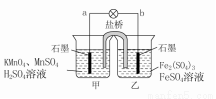
 移向甲烧杯
移向甲烧杯
 液X中一定不存在的离子有:
液X中一定不存在的离子有: 为
为 ;
; 体中的氢原子数一定大于2NA
体中的氢原子数一定大于2NA )>c(NH
)>c(NH )
)