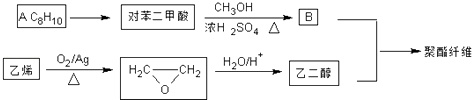
题目内容
【题目】某强酸性溶液X含有Ba2+、Al3+、NH![]() 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO![]() 、SO
、SO![]() 、SO
、SO![]() 、Cl-、NO
、Cl-、NO![]() 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:
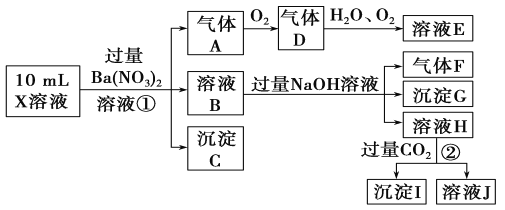
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是________________________________;可能存在的离子是______________________________;
(2)写出有关离子方程式:步骤①中生成A__________________________;步骤②生成沉淀I___________________________________________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量为0.07 mol,能说明该溶液不能确定的阴离子存在的理由是______________________________。
【答案】 Al3+、NH![]() 、Fe2+、SO
、Fe2+、SO![]() Fe3+、Cl- 3Fe2++NO
Fe3+、Cl- 3Fe2++NO![]() +4H+===3Fe3++NO↑+2H2O AlO
+4H+===3Fe3++NO↑+2H2O AlO![]() +CO2+2H2O===Al(OH)3↓+HCO
+CO2+2H2O===Al(OH)3↓+HCO![]() 若检验Fe3+肯定存在时,就有Cl-存在,因为肯定存在的离子电荷总数已相等
若检验Fe3+肯定存在时,就有Cl-存在,因为肯定存在的离子电荷总数已相等
【解析】在强酸性溶液中一定不会存在![]() 和
和![]() 离子,加入过量硝酸钡生成沉淀,则该沉淀为
离子,加入过量硝酸钡生成沉淀,则该沉淀为![]() 沉淀,说明溶液中含有
沉淀,说明溶液中含有![]() 离子,生成气体A,A连续氧化生成D和E,则A为NO,D为
离子,生成气体A,A连续氧化生成D和E,则A为NO,D为![]() ,E为
,E为![]() ,硝酸根离子变为一氧化氮,被还原,说明溶液中应含有还原性离子,一定为
,硝酸根离子变为一氧化氮,被还原,说明溶液中应含有还原性离子,一定为![]() 离子;溶液B中加入过量NaOH溶液,生成气体F,则F为
离子;溶液B中加入过量NaOH溶液,生成气体F,则F为![]() ,说明溶液中含有
,说明溶液中含有![]() 离子,溶液H中溶于
离子,溶液H中溶于![]() 气体,生成沉淀I,则I为
气体,生成沉淀I,则I为![]() ,H为NaOH和
,H为NaOH和![]() ,说明溶液中含有
,说明溶液中含有![]() 离子,溶液中含有
离子,溶液中含有![]() 离子,就一定不含
离子,就一定不含![]() 离子,含有
离子,含有![]() 离子就一定不含
离子就一定不含![]() 离子,不能确定是否含有的离子
离子,不能确定是否含有的离子![]() 和
和![]() 。
。
(1)中除![]() 外还肯定含有的离子是Al3+、NH
外还肯定含有的离子是Al3+、NH![]() 、Fe2+、SO
、Fe2+、SO![]() ;可能存在的离子:Fe3+、Cl- ;正确答案: Al3+、NH
;可能存在的离子:Fe3+、Cl- ;正确答案: Al3+、NH![]() 、Fe2+、SO
、Fe2+、SO![]() ;Fe3+、Cl- 。
;Fe3+、Cl- 。
(2)) ![]() 离子被氧化为
离子被氧化为![]() 离子,反应的离子方程式为3Fe2++NO
离子,反应的离子方程式为3Fe2++NO![]() +4H+===3Fe3++NO↑+2H2O ;H为NaOH和
+4H+===3Fe3++NO↑+2H2O ;H为NaOH和![]() 混合物,通入过量二氧化碳后分别发生的反应为:
混合物,通入过量二氧化碳后分别发生的反应为:![]() ,则生成沉淀的离子方程式为: AlO
,则生成沉淀的离子方程式为: AlO![]() +CO2+2H2O===Al(OH)3↓+HCO
+CO2+2H2O===Al(OH)3↓+HCO![]() ;正确答案:3Fe2++NO
;正确答案:3Fe2++NO![]() +4H+===3Fe3++NO↑+2H2O ;AlO
+4H+===3Fe3++NO↑+2H2O ;AlO![]() +CO2+2H2O===Al(OH)3↓+HCO
+CO2+2H2O===Al(OH)3↓+HCO![]() 。
。
(3)A、F、I均为![]() ,
,![]() 溶液中
溶液中![]() ,根据反应3Fe2++NO
,根据反应3Fe2++NO![]() +4H+===3Fe3++NO↑+2H2O ,可以知道
+4H+===3Fe3++NO↑+2H2O ,可以知道![]() 物质的量为
物质的量为![]() ;则溶液中正电荷为:
;则溶液中正电荷为:![]() ;沉淀C为硫酸钡,其物质的量
;沉淀C为硫酸钡,其物质的量![]() ,
,![]() ,硫酸根离子所带的负电荷为:
,硫酸根离子所带的负电荷为:![]() ,说明溶液中正负电荷相等,所以若检验
,说明溶液中正负电荷相等,所以若检验![]() 肯定存在时,就有
肯定存在时,就有![]() 存在,因肯定存在的离子电荷总数已相等;正确答案:若检验Fe3+肯定存在时,就有Cl-存在,因为肯定存在的离子电荷总数已相等。
存在,因肯定存在的离子电荷总数已相等;正确答案:若检验Fe3+肯定存在时,就有Cl-存在,因为肯定存在的离子电荷总数已相等。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。玉溪一中化学兴趣小组在实验室中对NH3与NO2反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为____________________。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→_____________(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中____________ | ②反应的化学方程式______,该反应中被氧化和被还原的氮元素的质量比是____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
打开K2 | ③____________ | ④______________ |
【题目】某次实验室制取乙酸丁酯所用原料为:7.4mL1﹣丁醇、6.0mL冰醋酸,1.0mL浓硫酸.若制得乙酸丁酯(式量116)的质量为5.12g,则以下正确的是( )
1﹣丁醇 | 冰醋酸 | |
密度(g/cm3) | 0.81 | 1.05 |
摩尔质量(g/mol) | 74 | 60 |
A.产率:约54.49%
B.产率:约42.04%
C.转化率:冰醋酸小于1﹣丁醇
D.转化率:冰醋酸大于1﹣丁醇