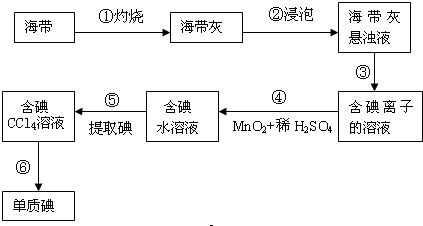
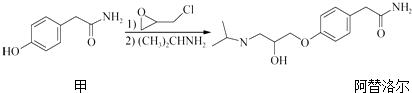
题目内容
【题目】电解法制碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、SO42﹣杂质,不符合电解要求,因此必须经过精制.某校实验小组精制粗盐水的实验过程如下:
请回答以下问题:
(1)操作a的名称是 , 所用玻璃仪器有;
(2)在Ⅱ步中,加入过量试剂甲后,生成了两种大量的难溶沉淀,则试剂甲为(填化学式)溶液;
(3)写出固体H所含物质的化学式;
(4)在Ⅴ步中,逐滴加入试剂丁直至溶液无明显变化时,写出此过程中发生反应的离子方程式; .
【答案】
(1)过滤,烧杯、漏斗、玻璃棒
(2)NaOH
(3)BaCO3、CaCO3
(4)H++OH﹣=H2O,2H++CO32﹣=CO2↑+H2O
【解析】解:(1)在食盐水中,实现溶液和泥沙难溶物的分离可以采用过滤的方法;
(2)粗盐中含有Ca2+、Mg2+、Fe3+、SO42﹣杂质,加入过量试剂氢氧化钠后,可以将镁离子以及铁离子形成氢氧化镁和氢氧化铁沉淀;
(3)氯化钡可以让硫酸根离子形成硫酸钡沉淀,碳酸钠可以让钙离子以及过量的钡离子形成碳酸钙和碳酸钡沉淀,并且碳酸钠必须加在氯化钡之后,在第Ⅴ步中,加入试剂盐酸可以讲过量的氢氧化钠以及过量的碳酸钠除掉;
(4)在第Ⅴ步中,加入试剂盐酸可以讲过量的氢氧化钠以及过量的碳酸钠除掉,此过程的化学方程式为:H++OH﹣=H2O;2H++CO32﹣=CO2↑+H2O;
所以答案是:(1)过滤;(2)NaOH;(3)CaCO3和BaCO3;(4)H++OH﹣=H2O;2H++CO32﹣=CO2↑+H2O

练习册系列答案
相关题目