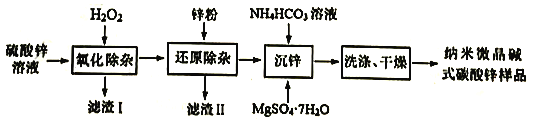
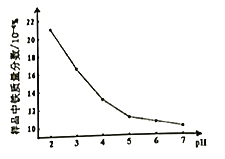
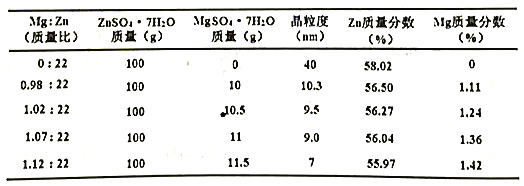
题目内容
【题目】实验室可利用NaCl溶液和AgNO3溶液制备胶体,也可以反应生成沉淀,图中圆的大小代表分散质粒子的相对大小。下列说法正确的是

A. 分散系Ⅰ为溶液
B. 制备分散系I的离子方程式为Ag++Cl-=AgCl(胶体)
C. 分散系Ⅱ为胶体
D. 两分散系的本质区别是是否有丁达尔现象
【答案】B
【解析】
根据分散质粒子直径大小来分类,可分为溶液(小于1nm)、胶体(1-100nm)和浊液(大于100nm)实验室可利用NaCl溶液和AgNO3溶液制备胶体,也可以反应生成沉淀,根据题意可知,分散系Ⅰ为胶体,分散系II为沉淀,据此分析作答。
根据上述分析可知,
A. 分散系Ⅰ为胶体,A项错误;
B. 制备分散系I的离子方程式为Ag++Cl-=AgCl(胶体),B项正确;
C. 分散系II为沉淀,C项错误;
D. 两分散系的本质区别是分散质粒子直径的大小不同,D项错误;

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案【题目】甲醇是重要的化工原料,又可作为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=+41 kJ/mol
CO(g)+H2O(g) ΔH=+41 kJ/mol
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | x |
则x=_________。
(2)若将lmol CO2和2mol H2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应②。测得CH3OH的物质的量随时间的变化如图所示。

①曲线I、Ⅱ对应的平衡常数大小关系为KI_____KⅡ(填“>”或“=”或“<”);
②一定温度下,能判断该反应达到化学平衡状态的是_____________。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=O断裂的同时有6个H—H断裂
③若5min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率________;该温度下的平衡常数为______;若保持容器温度不变,下列措施可增加甲醇产率的________。
a.缩小反应容器的容积 b.使用合适的催化剂
c.充入He d.按原比例再充入CO2和H2
【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装 置 |
|
|
|
|
部分实验现象 | a极质量减小;b极质量增加 | b极有气体产生;c极无变化 | d极溶解;c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c