题目内容
【题目】过碳酸钠(![]() )在生产和生活领域应用广泛,其制备反应为:
)在生产和生活领域应用广泛,其制备反应为:![]()
![]() 。过碳酸钠具有Na2CO3和H2O2的双重性质, 在500C时分解为碳酸钠和过氧化氢。下列有关说法错误的是
。过碳酸钠具有Na2CO3和H2O2的双重性质, 在500C时分解为碳酸钠和过氧化氢。下列有关说法错误的是
A. 实验室制备过碳酸钠时可釆用冷水浴控制反应温度
B. 过碳酸钠水溶液呈碱性,可用作漂洗剂和消毒杀菌剂
C. 过碳酸钠应密封保存,放置于冷暗处
D. 过碳酸钠可使酸性高锰酸钾溶液褪色,并放出一种无色气体
【答案】D
【解析】A.在50℃时分解为碳酸钠和过氧化氢,则制备过碳酸钠时可釆用冷水浴控制反应温度,不能使反应温度过高,故A正确;B.碳酸钠具有Na2CO3和H2O2的双重性质,其中碳酸钠水解呈碱性,过氧化氢具有强氧化性,可用于漂洗剂和消毒杀菌剂,故B正确;C.过碳酸钠应密封保存,放置于冷暗处,可防止温度过高而分解,故C正确;D.过碳酸钠可使酸性高锰酸钾溶液褪色,其中碳酸钠与酸反应生成二氧化碳气体,过氧化氢与高锰酸钾发生氧化还原反应生成氧气,则生成两种气体,故D错误.故选D.

【题目】I.控制变量法是化学实验中的—种常用方法,如表是某课外兴趣小组研究等物质的量浓度的稀硫酸和锌反应的实验数据(计算结果精确到小数点—位),分析以下数据,回答下列问题:
序号 | 硫酸的体积 /mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的 时间/s | 生成硫酸锌的质量/g |
① | 50.0 | 2.0 | 薄片 | 15 | 200 | m1 |
② | 50.0 | 2.0 | 薄片 | 25 | 100 | m2 |
③ | 50.0 | 2.0 | 颗粒 | 25 | 70 | m3 |
④ | 50.0 | 2.0 | 颗粒 | 35 | 35 | m4 |
⑤ | 50.0 | 2.0 | 粉末 | 25 | t1 | 5.0 |
⑥ | 50.0 | 4.0 | 粉末 | 25 | t2 | m5 |
⑦ | 50.0 | 6.0 | 粉末 | 25 | t3 | 14.9 |
⑧ | 50.0 | 8.0 | 粉末 | 25 | t4 | 19.3 |
⑨ | 50.0 | 10.0 | 粉末 | 25 | t5 | 19.3 |
(1)实验①和实验②表明_____对反应速率有影响;研究锌的形状对反应速率的影响时,最好选取实验_______ (填3个实验序号)。
(2)下列数据推断正确的是______________________。
A. t1<70 B.t1>t4 C.m12 D.m6=19.3
(3)若采用与实验①完全相同的条件,但向反应窗口中滴加少量硫酸铜溶液,发现反应速率明显加快,原因是___________________________________。
(4)根据表中数据计算:硫酸的物质的量浓度是_________________mol/L。
II.己知在 25℃、l0l kPa 下,2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),现将 2molNO、2.4molCO通入恒容密闭容器中,反应过程中部分物质的浓度变化如图所示。
N2(g)+2CO2(g),现将 2molNO、2.4molCO通入恒容密闭容器中,反应过程中部分物质的浓度变化如图所示。
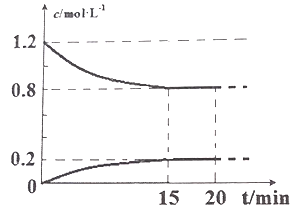
(1) 015min 内,v(CO2) =__________________。
(2)该反应的速率时间图像如下图中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图像如下图中右图所示。以下说法正确的是______(填对应字母)。
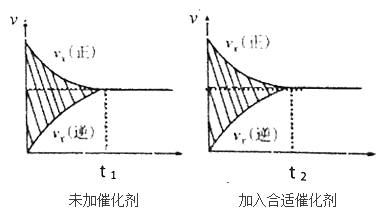
A.a1>a2 B.b12 C.t1>t2
(3) 一定条件下,己知反应NO2(g)+SO2(g) ![]() NO(g)+SO3(g),将NO2
NO(g)+SO3(g),将NO2
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO2与SO2的体积比保持不变 d.每消耗lmol SO2的同时生成lmol NO