题目内容
在标准状况下
①6.72L CH4 ②3.01×1023个HCl分子
③13.6g H2S ④0.2mol NH3,
下列对这四种气体的关系从大到小表达正确的是
A.体积②>③>①>④ B.密度②>③>①>④
C.质量②>③>①>④ D.氢原子个数②>④>③>①
AC
【解析】

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
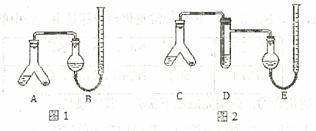
唐印文化课时测评系列答案甲、乙两个研究性学习小组为测定氨分子张氮、氢原子个数比,设计了如下实验流程:

试验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完成后,黑色的氧化铜转化为红色的铜。
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛,有浓硫酸的洗气瓶。

甲小组测得:反应前氧化铜的质量为![]() 、氧化铜反应后剩余固体的质量为
、氧化铜反应后剩余固体的质量为![]()
![]() 生成氮气在标准状况下的体积
生成氮气在标准状况下的体积![]() 。
。
乙小组测得:洗气前装置D的质量![]() 、洗气后装置后D的质量
、洗气后装置后D的质量![]() 、生成氮气在标准状况下的体积
、生成氮气在标准状况下的体积![]() 。
。
请回答下列问题:
(1)写出仪器a的名称: 。
(2)检查A装置气密性的操作时 。
(3)甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为 ① |
| 乙小组 | ② | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③
|
(4)甲小组用所测数据计算出氨分子中氮、氢的原子个数之比为 。
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数比名校小于理论值,其原因是 。 为此,乙小组在原有实验的基础上增加了一个装有药品的实验仪器,重新实验。根据实验前后该药品的质量变化及生成氮气的体积,得出合理的实验结果。该药品的名称是 。