题目内容
已知:Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,能氧化浓HCl生成Cl2;PbO2不稳定,随温度升高按下列顺序逐步分解:PbO2→Pb2O3→Pb3O4→PbO.现将a mol PbO2加热分解,收集产生的O2;向加热后所得固体中加入足量的浓盐酸,收集产生的Cl2.加热反应后所得固体中,Pb2+占Pb元素的物质的量分数为x;两步反应中收集的O2和Cl2的物质的量之和为y mol.
试回答下列问题:
(1)试写出Pb2O3与浓盐酸反应的化学方程式______.
(2)用含X与a的表达式表示产生的O2、Cl2的物质的量n(O2)=______ n(Cl2)=______
(3)写出y与a、x的函数关系式.______
(4)若两步反应中O2和Cl2的物质的量之比为5:3,则剩余固体中含有的物质为______;其物质的量之比为______.
解:(1)Pb2O3中Pb的化合价只有+3,且+3价的Pb具有氧化性,能氧化浓盐酸生成C12,本身被还原成+2价Pb,生成PbC12,根据元素守恒得反应物与生成物并根据化合价升降法配平该氧化还原反应,得出Pb2O3+6HCl(浓)═2PbCl2+Cl2↑+3H2O,故答案为:Pb2O3+6HCl(浓)═2PbCl2+Cl2↑+3H2O;
(2)根据题意:1mol PbO2分解所得混合物中n(Pb2+)=x mol、n(Pb4+)=(1-x) mol.在反应过程中1mol PbO2中+4价的Pb具有强氧化性作氧化剂,
+4价的Pb最终全部降低为+2价,根据得失电子守恒:先加热分解生成O2,得n(O2)=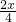 a=
a=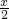 amol;
amol;
后再与足量的浓盐酸反应生成Cl2,得n(Cl2)=a×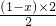 =(1-x)a mol,
=(1-x)a mol,
故答案为: mol;a(1-x)mol;
mol;a(1-x)mol;
(3)y=n(O2)+n(Cl2)=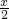 mol+(1-x)a mol=(1-
mol+(1-x)a mol=(1-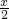 )amol,
)amol,
故答案为:y=(1-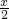 )amol;
)amol;
(4)若两步反应中O2和Cl2的物质的量之比为5:3,根据上述分析:n(O2)=a×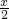 =mol,n(Cl2)=a(1-x)mol,即
=mol,n(Cl2)=a(1-x)mol,即 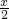 :(1-x)=5:3,
:(1-x)=5:3,
解得:x═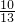 ,则剩余固体中含pb2+的物质的量分数为
,则剩余固体中含pb2+的物质的量分数为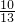 ,含pb4+的物质的量分数为
,含pb4+的物质的量分数为 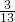 ,即n(pb2+):n(pb4+)═10:3,
,即n(pb2+):n(pb4+)═10:3,
由题意,PbO2不稳定逐步分解顺序:PbO2→Pb2O3→Pb3O4→PbO.因为Pb的化合价只有+2、+4,所以Pb2O3可表示为
PbO?PbO2,Pb3O4可表示为2PbO?PbO2,各氧化物中n(pb2+):n(pb4+)的比值关系为:
PbO2中,n(pb2+):n(pb4+)═0:1
Pb2O3中,n(pb2+):n(pb4+)═1:1
Pb3O4中,n(pb2+):n(pb4+)═2:1
PbO中,n(pb2+):n(pb4+)═1:0
根据剩余固体中n(pb2+):n(pb4+)═10:3,介于3:1和4:1之间,所以此时剩余固体包括Pb3O4、PbO两种物质,.
设剩余固体中Pb3O4物质的量为a、PbO物质的量为b,
得n(pb2+)═2a+b,n(pb4+)═a,
则(2a+b):a═10:3
解得a:b═3:4,即Pb3O4:PbO=3:4,
故答案为:Pb3O4、PbO;3:4.
分析:(1)Pb2O3中+3价的Pb具有强氧化性,能氧化浓盐酸,+3价的Pb被浓盐酸还原成+2价,确定生成物PbC12、C12、H2O,再配平可得化学方程式;
(2)根据题意,确定反应物为PbO2,写出方程式,再利用方程式进行计算求解;
(3)根据氧化还原反应的本质电子得失守恒求出n(O2)、n(Cl2),即得y与x的函数关系;
(4)根据两步反应中O2和Cl2的物质的量之比为3:5,求出x的值,确定出n(pb2+):n(pb4+)的比值,再设法求解即可.
点评:本题考查氧化还原反应知识,利用化合价升降法配平,抓住本质电子的得失守恒是解题的关键,同时结合中间值确定反应产物.该题对抽象思维能力要求较高,很容易感觉无从下笔,难度较大.
(2)根据题意:1mol PbO2分解所得混合物中n(Pb2+)=x mol、n(Pb4+)=(1-x) mol.在反应过程中1mol PbO2中+4价的Pb具有强氧化性作氧化剂,
+4价的Pb最终全部降低为+2价,根据得失电子守恒:先加热分解生成O2,得n(O2)=
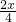 a=
a=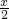 amol;
amol;后再与足量的浓盐酸反应生成Cl2,得n(Cl2)=a×
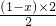 =(1-x)a mol,
=(1-x)a mol,故答案为:
 mol;a(1-x)mol;
mol;a(1-x)mol;(3)y=n(O2)+n(Cl2)=
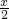 mol+(1-x)a mol=(1-
mol+(1-x)a mol=(1-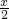 )amol,
)amol,故答案为:y=(1-
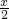 )amol;
)amol;(4)若两步反应中O2和Cl2的物质的量之比为5:3,根据上述分析:n(O2)=a×
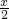 =mol,n(Cl2)=a(1-x)mol,即
=mol,n(Cl2)=a(1-x)mol,即 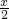 :(1-x)=5:3,
:(1-x)=5:3,解得:x═
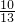 ,则剩余固体中含pb2+的物质的量分数为
,则剩余固体中含pb2+的物质的量分数为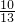 ,含pb4+的物质的量分数为
,含pb4+的物质的量分数为 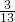 ,即n(pb2+):n(pb4+)═10:3,
,即n(pb2+):n(pb4+)═10:3,由题意,PbO2不稳定逐步分解顺序:PbO2→Pb2O3→Pb3O4→PbO.因为Pb的化合价只有+2、+4,所以Pb2O3可表示为
PbO?PbO2,Pb3O4可表示为2PbO?PbO2,各氧化物中n(pb2+):n(pb4+)的比值关系为:
PbO2中,n(pb2+):n(pb4+)═0:1
Pb2O3中,n(pb2+):n(pb4+)═1:1
Pb3O4中,n(pb2+):n(pb4+)═2:1
PbO中,n(pb2+):n(pb4+)═1:0
根据剩余固体中n(pb2+):n(pb4+)═10:3,介于3:1和4:1之间,所以此时剩余固体包括Pb3O4、PbO两种物质,.
设剩余固体中Pb3O4物质的量为a、PbO物质的量为b,
得n(pb2+)═2a+b,n(pb4+)═a,
则(2a+b):a═10:3
解得a:b═3:4,即Pb3O4:PbO=3:4,
故答案为:Pb3O4、PbO;3:4.
分析:(1)Pb2O3中+3价的Pb具有强氧化性,能氧化浓盐酸,+3价的Pb被浓盐酸还原成+2价,确定生成物PbC12、C12、H2O,再配平可得化学方程式;
(2)根据题意,确定反应物为PbO2,写出方程式,再利用方程式进行计算求解;
(3)根据氧化还原反应的本质电子得失守恒求出n(O2)、n(Cl2),即得y与x的函数关系;
(4)根据两步反应中O2和Cl2的物质的量之比为3:5,求出x的值,确定出n(pb2+):n(pb4+)的比值,再设法求解即可.
点评:本题考查氧化还原反应知识,利用化合价升降法配平,抓住本质电子的得失守恒是解题的关键,同时结合中间值确定反应产物.该题对抽象思维能力要求较高,很容易感觉无从下笔,难度较大.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目