题目内容
(12分〉某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀。查阅资料得知常温下BaSO3的KSP为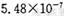 ,饱和亚硫酸中
,饱和亚硫酸中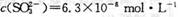 。
。
(1) 将0.1 mol • L—1的BaCl2溶液滴入饱和亚硫酸中,_______ (填“能”或“不能”)生成BaSO3沉淀,原因是______________ (请写出必要的推断过程)。
(2) 浓硫酸的沸点为338°C,酒精灯火焰的温度为400〜5000C,甲同学用装置I进行实验,发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸。
①写出加热试管中发生反应的化学方程式:_____________________
②白色沉淀的化学式是_______,请用离子方程式表示生成该白色沉淀的可能原因___________________________________
(3) 乙同学认为甲同学的装置不完善,设计了改进装置II进行实验(夹持装置和A中加热装置已略,气密性已检验)。
①打开弹簧夹,通入N2—段时间后关闭弹簧夹
②滴加一定量浓硫酸,加热A,一段时间后C中未见沉淀生成。
操作①的目的是_______,洗气瓶B中的试剂是______________。
(4) 丙同学取乙实验后的C中溶液少许,滴加一种无色溶液,也产生不溶于盐酸的白色沉淀,丙滴加的试剂可能是______________。
A. NaOH 溶液 B. Na[Al(OH)4]溶液 C. H2O2 溶液 D.酸性 KMnO4 溶液
(12分)(1)不能(1分) 此时溶液中c(Ba2+)<0.1 mol· L-1 , c(SO32-)<6.3×10-8mol· L-1,
其浓度商Q=c(Ba2+)×c(SO32-)<0.1×6.3×10-8=6.3×10-9<Ksp(BaSO3)=5.48×10-7(1分)
(2)① Cu + 2H2SO4(浓)  CuSO4+
SO2↑+ 2H2O(2分)
CuSO4+
SO2↑+ 2H2O(2分)
② BaSO4(1分)
Ba2++ SO42-= BaSO4↓(2分) 2 Ba2++ 2SO2 + O2+2H2O= 2BaSO4↓+ 4H+(2分)
(3)排除装置内的空气(O2)(1分) 饱和NaHSO3溶液(1分) (4)C(1分)
【解析】本题考查难溶电解质沉淀溶解平衡。由于溶液冲稀,溶液中c(Ba2+)<0.1 mol· L-1 , c(SO32-)<6.3×10-8mol· L-1,其浓度商Q=c(Ba2+)×c(SO32-)<0.1×6.3×10-8=6.3×10-9<Ksp(BaSO3)=5.48×10-7,故不会生成BaSO3沉淀。(2) ①浓硫酸与铜反应的方程式为Cu+2H2SO4(浓)  CuSO4+ SO2↑+2H2O②由于SO2与BaCl2溶液作用不产生沉淀,根据酒精灯的的温度,可知,浓硫酸受热气化进入BaCl2溶液,发生反应生成BaSO4沉淀。离子方程式为Ba2++ SO42-=
BaSO4↓。(3)通入N2的目的是排除装置内的空气(O2),防止O2和SO2反应生成SO3,影响实验结果。再用饱和NaHSO3溶液除去硫酸蒸汽,防止硫酸蒸汽影响实验结果。(4) 乙实验后的C中溶液是BaCl2和亚硫酸混合溶液,加碱或氧化剂都能产生沉淀,但加碱产生的沉淀能溶液于盐酸,且酸性 KMnO4 溶液有颜色,故选C,
CuSO4+ SO2↑+2H2O②由于SO2与BaCl2溶液作用不产生沉淀,根据酒精灯的的温度,可知,浓硫酸受热气化进入BaCl2溶液,发生反应生成BaSO4沉淀。离子方程式为Ba2++ SO42-=
BaSO4↓。(3)通入N2的目的是排除装置内的空气(O2),防止O2和SO2反应生成SO3,影响实验结果。再用饱和NaHSO3溶液除去硫酸蒸汽,防止硫酸蒸汽影响实验结果。(4) 乙实验后的C中溶液是BaCl2和亚硫酸混合溶液,加碱或氧化剂都能产生沉淀,但加碱产生的沉淀能溶液于盐酸,且酸性 KMnO4 溶液有颜色,故选C,

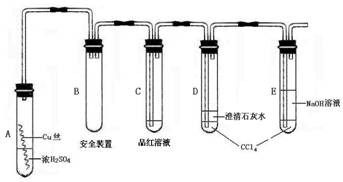
(本题共12分)某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
实验选用细铜丝、98.3% H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
|
根据上述材料回答下列问题
(1)A试管上方的长导管的作用是_________________;D、E两支试管中CCl4的作用是_____________。
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式:____。
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是:___________。设计实验验证你的猜想________________。
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是_____。(写化学式)
(本题共12分)某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)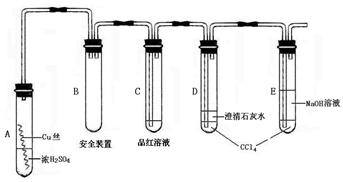
实验选用细铜丝、98.3% H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
|

根据上述材料回答下列问题
(1)A试管上方的长导管的作用是_________________;D、E两支试管中CCl4的作用是_____________。
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式:____。
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是:___________。设计实验验证你的猜想________________。
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是_____。(写化学式)
(本题共12分)某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
实验选用细铜丝、98.3% H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
|

根据上述材料回答下列问题
(1)A试管上方的长导管的作用是_________________;D、E两支试管中CCl4的作用是_____________。
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式:____。
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是:___________。设计实验验证你的猜想________________。
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是_____。(写化学式)