题目内容
 “可燃冰”是一种重要的潜在未来资源.“可燃冰”属于主要成分是CH4的水合物.
“可燃冰”是一种重要的潜在未来资源.“可燃冰”属于主要成分是CH4的水合物.(1)CH4可与Cl2反应,反应历程如下
①Cl-Cl→2Cl?△H=243kJ?mol-1
②Cl?+CH3-H→?CH3+H-Cl△H=4KJ?mol-1
③?CH3+Cl-Cl→CH3-Cl+Cl?△H=-106kJ?mol-1
则2摩氯原子结合成1摩氯分子时,放出的能量为
243
243
kJ;CH4与Cl2反应生成CH3Cl(g)的热化学方程式为CH4(g)+Cl2(g)═CH3Cl(g)+HCl(g) △H=-102kJ?mol-1
CH4(g)+Cl2(g)═CH3Cl(g)+HCl(g) △H=-102kJ?mol-1
.(2)CH4也是一种重要的化工原料,如它与CO2在高温下可以反应制取CO,请写出反应的化学方程式
CH4 +CO2
2CO+2H2
| ||
CH4 +CO2
2CO+2H2
;实验室可用CHCl3与H2O2直接反应制取COCl2,反应的化学方程式为
| ||
CHCl3 +H2O2═COCl2+HCl+H2O;
CHCl3 +H2O2═COCl2+HCl+H2O;
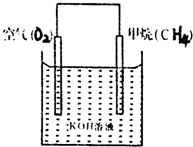
.(3)CH4可用于设计燃料电池,甲烷燃料电池的工作原理如图所示:则通入CH4的一极为原电池的
负极
负极
(填“正极”或“负极”),正极的电极反应式为O2+4e-+2H2O═4OH-
O2+4e-+2H2O═4OH-
,该电池工作时总的反应方程式为CH4 +2O2+2KOH═K2CO3+3H2O
CH4 +2O2+2KOH═K2CO3+3H2O
.分析:(1)一个反应无论是一步完成还是分为几步完成,其热效应是相同的,故根据盖斯定律可求题目中的反应热;
(2)CH4与CO2在高温下可以反应制取CO,另一种产物是H2,反应方程式即可得出;CHCl3与H2O2直接反应制取COCl2,同时伴随HCl和H2O的生成;
(3)甲烷燃料电池是根据甲烷的燃烧反应设计的,甲烷发生氧化反应,故通甲烷的极为负极.正极是氧气放电生成OH-,总方程式书写时要考虑生成的二氧化碳和碱的反应.
(2)CH4与CO2在高温下可以反应制取CO,另一种产物是H2,反应方程式即可得出;CHCl3与H2O2直接反应制取COCl2,同时伴随HCl和H2O的生成;
(3)甲烷燃料电池是根据甲烷的燃烧反应设计的,甲烷发生氧化反应,故通甲烷的极为负极.正极是氧气放电生成OH-,总方程式书写时要考虑生成的二氧化碳和碱的反应.
解答:解:(1)根据盖斯定律可知,(-①)即是氯原子结合成氯分子时的热化学方程式:2Cl?→Cl-Cl△H=-243kJ?mol-1,
可知2mol氯原子结合成1mol氯分子时,放出的热量为243kJ;
由②+③可知CH4与Cl2反应生成CH3Cl(g)的热化学方程式为:CH4(g)+Cl2(g)═CH3Cl(g)+HCl(g) △H=-102kJ?mol-1
故答案为:243; CH4(g)+Cl2(g)═CH3Cl(g)+HCl(g) △H=-102kJ?mol-1;
(2)CH4与CO2在高温下反应生成CO、H2:CH4 +CO2
2CO+2H2;
实验室用CHCl3与H2O2反应制取COCl2,反应的化学方程式:CHCl3 +H2O2═COCl2+HCl+H2O;
故答案为:CH4 +CO2
2CO+2H2; CHCl3 +H2O2═COCl2+HCl+H2O;
(3)在原电池中,负极发生氧化反应,正极发生还原反应.甲烷燃料电池根据甲烷的燃烧反应设计,在反应中,甲烷发生氧化反应故在负极放电,故通入CH4
的一极为原电池的负极;
正极是氧气放电,考虑到电解质溶液为碱性,故电极反应为:O2+4e-+2H2O═4OH-;
该燃料电池先发生反应:CH4 +2O2═CO2+2H2O ①生成的 CO2 又发生了和电解质溶液的反应:CO2+2KOH═K2 CO3+H2O ②
将①+②即得总反应:CH4 +2O2+2KOH═K2CO3+3H2O
故答案为:负极; O2+4e-+2H2O═4OH-; CH4 +2O2+2KOH═K2CO3+3H2O.
可知2mol氯原子结合成1mol氯分子时,放出的热量为243kJ;
由②+③可知CH4与Cl2反应生成CH3Cl(g)的热化学方程式为:CH4(g)+Cl2(g)═CH3Cl(g)+HCl(g) △H=-102kJ?mol-1
故答案为:243; CH4(g)+Cl2(g)═CH3Cl(g)+HCl(g) △H=-102kJ?mol-1;
(2)CH4与CO2在高温下反应生成CO、H2:CH4 +CO2
| ||
实验室用CHCl3与H2O2反应制取COCl2,反应的化学方程式:CHCl3 +H2O2═COCl2+HCl+H2O;
故答案为:CH4 +CO2
| ||
(3)在原电池中,负极发生氧化反应,正极发生还原反应.甲烷燃料电池根据甲烷的燃烧反应设计,在反应中,甲烷发生氧化反应故在负极放电,故通入CH4
的一极为原电池的负极;
正极是氧气放电,考虑到电解质溶液为碱性,故电极反应为:O2+4e-+2H2O═4OH-;
该燃料电池先发生反应:CH4 +2O2═CO2+2H2O ①生成的 CO2 又发生了和电解质溶液的反应:CO2+2KOH═K2 CO3+H2O ②
将①+②即得总反应:CH4 +2O2+2KOH═K2CO3+3H2O
故答案为:负极; O2+4e-+2H2O═4OH-; CH4 +2O2+2KOH═K2CO3+3H2O.
点评:本题综合考查了盖斯定律和燃料电池电极反应、总反应的书写,难度适中,综合性较强.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案
相关题目