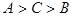题目内容
(10分)X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大。
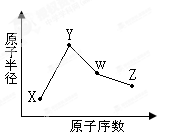
(1)W位于元素周期表中第 周期第 族画出X的阴离子的结构示意图 。
(2)Z的氢化物和溴化氢相比,较稳定的是 (写化学式);Z的氢化物与氟化氢相比,沸点较高的是 (写化学式)。
(3)Y的金属性与Mg的金属性相比, (写化学式)的金属性强,请用实验证明它们金属性的相对强弱: 。
(4)写出Y的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物发生反应的化学反应方程式 。

(1)W位于元素周期表中第 周期第 族画出X的阴离子的结构示意图 。
(2)Z的氢化物和溴化氢相比,较稳定的是 (写化学式);Z的氢化物与氟化氢相比,沸点较高的是 (写化学式)。
(3)Y的金属性与Mg的金属性相比, (写化学式)的金属性强,请用实验证明它们金属性的相对强弱: 。
(4)写出Y的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物发生反应的化学反应方程式 。
(10分)(1)三、ⅣA 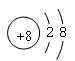 (各1分)
(各1分)
(2)HCl HF (各1分)
(3)Na (1分)Na与冷水反应剧烈,而Mg与冷水反应缓慢(其他答案合理也可)(2分)
(4)NaOH+HClO4=NaClO4+H2O (2分)
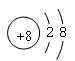 (各1分)
(各1分)(2)HCl HF (各1分)
(3)Na (1分)Na与冷水反应剧烈,而Mg与冷水反应缓慢(其他答案合理也可)(2分)
(4)NaOH+HClO4=NaClO4+H2O (2分)
X的一种核素的质量数为18,中子数为10,则X是氧元素。W的单质是一种常见的半导体材料,所以W是硅。根据原子半径大小顺序可知,Y、W、Z属于第三周期,则Y是钠,Z是氯元素。
(1)氧离子的最外层电子数是8个,所以结构示意图为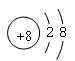 。
。
(2)非金属性越强,相应氢化物的稳定性越强。氯元素的非金属性强于溴元素的,所以氯化氢的稳定性强于溴化氢的。氟化氢分子中还原氢键,所以沸点高于氯化氢的。
(3)同周期自左向右金属性逐渐增强,所以钠的金属性强于镁的。比较金属性强弱可以用金属单质和水反应的剧烈程度来检验。Na与冷水反应剧烈,而Mg与冷水反应缓慢,所以钠强于镁。
(4)氢氧化钠和高氯酸反应的方程式为NaOH+HClO4=NaClO4+H2O。
(1)氧离子的最外层电子数是8个,所以结构示意图为
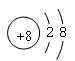 。
。(2)非金属性越强,相应氢化物的稳定性越强。氯元素的非金属性强于溴元素的,所以氯化氢的稳定性强于溴化氢的。氟化氢分子中还原氢键,所以沸点高于氯化氢的。
(3)同周期自左向右金属性逐渐增强,所以钠的金属性强于镁的。比较金属性强弱可以用金属单质和水反应的剧烈程度来检验。Na与冷水反应剧烈,而Mg与冷水反应缓慢,所以钠强于镁。
(4)氢氧化钠和高氯酸反应的方程式为NaOH+HClO4=NaClO4+H2O。

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
 B.
B. C.
C.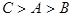 D.
D.