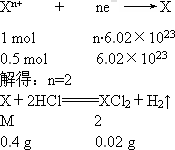题目内容
0.5 mol X元素的离子被还原成中性原子时,需要得到6.02×1023个电子;0.4 g X的单质与盐酸充分反应放出0.02 g氢气;Y元素的阴离子结构与氩原子结构相同,它的气态氢化物水溶液是强酸.
(1)推断X、Y两种元素的名称及在周期表中的位置.
(2)用电子式表示X、Y形成化合物的过程.
答案:
解析:
解析:
|
答案:(1)X为钙元素,位于第四周期第ⅡA族;Y为氯元素,位于第三周期第ⅦA族. (2) 思路解析:首先根据题意求得X的化合价n值以及X的相对原子质量M值 M= 根据题意知Y的气态氢化物是强酸,因Y的阴离子与氩原子结构相同,所以Y只能是氯元素17Cl. |

练习册系列答案
相关题目