题目内容
有关单质硫的性质的叙述,不正确的是
- A.硫既有氧化性又有还原性
- B.单质硫易溶于酒精,难溶于二硫化碳
- C.硫有可燃性
- D.硫有杀菌能力
B
硫是一种较活泼的非金属元素,单质硫中硫所呈现的0价是硫元素的一种中间价态,既可得到电子显示氧化性变成-2价,也可失去电子显示还原性变成+4、+6价;单质硫难溶于水、微溶于酒精、易溶于CS2;硫易燃烧生成SO2;硫对某些皮肤病有一定的疗效,可杀菌。
硫是一种较活泼的非金属元素,单质硫中硫所呈现的0价是硫元素的一种中间价态,既可得到电子显示氧化性变成-2价,也可失去电子显示还原性变成+4、+6价;单质硫难溶于水、微溶于酒精、易溶于CS2;硫易燃烧生成SO2;硫对某些皮肤病有一定的疗效,可杀菌。

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
下列有关物质的性质或应用说法不正确的是( )
| A、可用FeCl3溶液除去试管内壁上的难以刷去的铜迹 | B、浓硫酸能干燥氯气、一氧化碳等气体,说明浓硫酸具有吸水性 | C、二氧化硫具有漂白性,所以能使溴水和品红溶液褪色 | D、福尔马林、葡萄糖溶液与新制氢氧化铜悬浊液共热,都会有砖红色沉淀产生 |
下列有关NaHCO3和Na2CO3的性质比较中,不正确的是( )
| A、热稳定性:Na2CO3>NaHCO3 | B、常温时在水中的溶解度:Na2CO3>NaHCO3 | C、等物质的量的NaHCO3和Na2CO3与足量稀盐酸反应产生CO2的量:Na2CO3<NaHCO3 | D、等物质的量浓度的NaHCO3和Na2CO3与足量稀盐酸反应,放出的CO2的速率:Na2CO3<NaHCO3 |
硫元素具有可变价态,据此完成以下有关含硫化合物性质的试题.
(1)将H2S气体通入FeCl3溶液中,现象是 ;反应的离子方程式是 .
(2)为了探究-2价硫的化合物与+4价硫的化合物反应的条件,设计了下列实验.
已知:电离平衡常数:H2S K1=1.3×10-7;K2=7.1×10-15
H2SO3 K1=1.7×10-2;K2=5.6×10-8
①根据上述实验,可以得出结论:在 条件下,+4价硫的化合物可以氧化-2价硫的化合物.
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是 (选填编号).
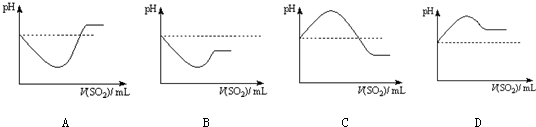
(3)现有试剂:溴水、硫化钠溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水.要证明Na2SO3具有还原性,应选用的试剂有 ,看到的现象是 .要证明Na2SO3具有氧化性,应选用的试剂有 ,反应的离子方程式是 .
(4)文献记载,常温下H2S可与Ag发生置换反应生成H2.现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应 .
(1)将H2S气体通入FeCl3溶液中,现象是
(2)为了探究-2价硫的化合物与+4价硫的化合物反应的条件,设计了下列实验.
| 实验操作 | 实验现象 | |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
H2SO3 K1=1.7×10-2;K2=5.6×10-8
①根据上述实验,可以得出结论:在
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是

(3)现有试剂:溴水、硫化钠溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水.要证明Na2SO3具有还原性,应选用的试剂有
(4)文献记载,常温下H2S可与Ag发生置换反应生成H2.现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应
关于铷的性质或用途中不正确的是( )
| A、单质与水反应发生爆炸 | B、单质的熔点比钾高 | C、氢氧化物的碱性比氢氧化钾要弱些 | D、单质为银色 |