题目内容
将22.8gNa2CO3和NaHCO3的固体混合物加热至固体质量不再变化时,经冷却,称得固体的质量为16.6g,求原混合物中Na2CO3质量分数.
【答案】分析:加热时NaHCO3分解,固体质量的变化是NaHCO3分解的缘故,可结合方程式用差量法计算.
解答:解:设混合物中含有xgNaHCO3,
2NaHCO3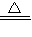 Na2CO3+CO2↑+H2O△m
Na2CO3+CO2↑+H2O△m
2×84g 62g
xg 22.8g-16.6g=6.2g
x=16.8g,
所以:m(Na2CO3)=22.8g-16.8g=6g,
w(Na2CO3)=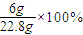 =26.3%,
=26.3%,
答:原混合物中Na2CO3质量分数为26.3%.
点评:本题考查混合物的计算,题目难度不大,注意差量法的运用.
解答:解:设混合物中含有xgNaHCO3,
2NaHCO3
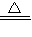 Na2CO3+CO2↑+H2O△m
Na2CO3+CO2↑+H2O△m2×84g 62g
xg 22.8g-16.6g=6.2g
x=16.8g,
所以:m(Na2CO3)=22.8g-16.8g=6g,
w(Na2CO3)=
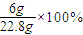 =26.3%,
=26.3%,答:原混合物中Na2CO3质量分数为26.3%.
点评:本题考查混合物的计算,题目难度不大,注意差量法的运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列所得溶液中,其物质的量浓度为1.0mol/L的是( )
| A、将20 g NaOH溶解在500 mL水中 | B、将22.4 L HCl气体溶于水配成1 L溶液 | C、将100 mL 10 mol/L的硫酸加入到900 mL水中 | D、将62.5 g胆矾(CuSO4?5H2O)溶解在适量水中,再加蒸馏水直到溶液的体积为250 mL |
 (2012?菏泽二模)合成氨反应(N2(g)+3H2(g)?2NH3(g))在工业生产中的大量运用,满足了人口的急剧增长对粮食的需求,也为化工生产提供了足够的原料.按要求回答下
(2012?菏泽二模)合成氨反应(N2(g)+3H2(g)?2NH3(g))在工业生产中的大量运用,满足了人口的急剧增长对粮食的需求,也为化工生产提供了足够的原料.按要求回答下