题目内容
【题目】0.1mol金属锡跟100mL12mol/LHNO3共热一段时间,完全反应后放出气体0.4mol,测定溶液c(H+)=8mol/L,溶液体积仍为100mL。由此推断氧化产物可能是
A. Sn(NO3)2 B. Sn(NO3)4
C. SnO24H2O D. Sn(NO3)2和Sn(NO3)4
【答案】C
【解析】试题分析:11.9g金属锡的物质的量=![]() =0.1mol,l2mol/L HNO3为浓硝酸,完全反应后测得溶液中的c(H+)=8mol/L,则浓硝酸有剩余,即锡与浓硝酸反应生成NO2,二氧化氮被氢氧化钠吸收生成盐,根据钠原子和氮原子的关系知,n(Na)=n(N)=0.4mol,所以生成的二氧化氮的物质的量为0.4mol,设金属锡被氧化后元素的化合价为x,由电子守恒可知,0.1mol×(x-0)=0.4mol×(5-4),解得x=+4,又溶液中c(H+)=8mol/L,而c(NO3-)=
=0.1mol,l2mol/L HNO3为浓硝酸,完全反应后测得溶液中的c(H+)=8mol/L,则浓硝酸有剩余,即锡与浓硝酸反应生成NO2,二氧化氮被氢氧化钠吸收生成盐,根据钠原子和氮原子的关系知,n(Na)=n(N)=0.4mol,所以生成的二氧化氮的物质的量为0.4mol,设金属锡被氧化后元素的化合价为x,由电子守恒可知,0.1mol×(x-0)=0.4mol×(5-4),解得x=+4,又溶液中c(H+)=8mol/L,而c(NO3-)=![]() =8mol/L,根据溶液电中性可判断溶液中不存在Sn(NO3)4,所以可能存在的是SnO24H2O,故选C。
=8mol/L,根据溶液电中性可判断溶液中不存在Sn(NO3)4,所以可能存在的是SnO24H2O,故选C。

练习册系列答案
相关题目
【题目】用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是 ( ) 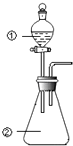
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 稀硫酸 | 硝酸亚铁溶液 | 无明显现象 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 氯化铝溶液 | 浓氢氧化钠溶液 | 立即产生大量白色沉淀 |
D | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
A.A
B.B
C.C
D.D