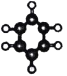
��Ŀ����
����Ŀ����֬�����̶Ⱦ�������֬�ij�Ĥ�ԡ�������һ�ֳ�Ĥ�����õĴ�������֬�ĺϳ�·�ߣ�����ͼ��ʾ��

��1��A��ϵͳ����Ϊ_______________��E�к��������ŵ�������_____________��
��2��д�����з�Ӧ�ķ�Ӧ���ͣ�B��C____________��C��D��____________��
��3��C�Ľṹ��ʽΪ___________��1molC�������NaOH_________mol��
��4��д��D��F��һ�����������ɴ�������֬�Ļ�ѧ����ʽ_____________��
��5��![]() �ķ�������������ͬ���칹����_______�֡�
�ķ�������������ͬ���칹����_______�֡�
�����Ķ�ȡ�����������FeCl3��Һ����ɫ�����ɷ�����ȥ��Ӧ
��6������������Ӧԭ�����Ա�ϩΪԭ�Ϻϳɱ�������������Ƴ������ķ�Ӧ����ͼ��_______________��
���𰸡�1-��ϩȩ���ӳɷ�Ӧȡ����ӦCH3-CHBr-CHBr-CH2Br3 6CH3CH=CH2
6CH3CH=CH2![]() CH2BrCH=CH2
CH2BrCH=CH2![]() CH2BrCHBrCH2Br
CH2BrCHBrCH2Br CH2OHCHOHCH2OH
CH2OHCHOHCH2OH
��������
�����и����ʵ�ת����ϵ��֪��CH3CH2CH2CH2Br�����������Ҵ���Һ�з�����ȥ��Ӧ����AΪCH3CH2CH=CH2��CH3CH2CH=CH2��NBS����֮������B����B�ķ���ʽΪC4H7Br����B������˳���칹����BΪCH3CHBrCH=CH2��CH3CHBrCH=CH2��Br2����CΪCH3CHBrCHBrCH2Br��CH3BrCH2CHBrCH2Br�ڼ���ˮ������DΪCH3CH��OH��CH��OH��CH2OH������ ��E��F��
��E��F��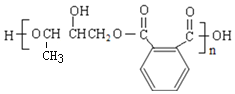 ����Ϸ�Ӧ������֪��EΪ
����Ϸ�Ӧ������֪��EΪ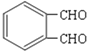 ��FΪ
��FΪ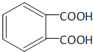 ���ݴ˴�����
���ݴ˴�����
��1��AΪCH3CH2CH=CH2��ϵͳ����Ϊ1-��ϩ��EΪ �����к��������ŵ�������ȩ������2��B��C��CH3CHBrCH=CH2��Br2�����ӳɷ�Ӧ����CH3CHBrCHBrCH2Br����Ӧ����Ϊ�ӳɷ�Ӧ��C��D��CH3BrCH2CHBrCH2Br���������Ƶ�ˮ��Һ�з���ˮ�ⷴӦ��Ҳ����ȡ����Ӧ����CH3CH��OH��CH��OH��CH2OH����Ӧ����Ϊȡ����Ӧ����3��C�Ľṹ��ʽΪCH3CHBr-CHBrCH2Br��1molC�������NaOH 3mol����4��D��F��һ�����������ɴ�������֬�Ļ�ѧ����ʽΪ
�����к��������ŵ�������ȩ������2��B��C��CH3CHBrCH=CH2��Br2�����ӳɷ�Ӧ����CH3CHBrCHBrCH2Br����Ӧ����Ϊ�ӳɷ�Ӧ��C��D��CH3BrCH2CHBrCH2Br���������Ƶ�ˮ��Һ�з���ˮ�ⷴӦ��Ҳ����ȡ����Ӧ����CH3CH��OH��CH��OH��CH2OH����Ӧ����Ϊȡ����Ӧ����3��C�Ľṹ��ʽΪCH3CHBr-CHBrCH2Br��1molC�������NaOH 3mol����4��D��F��һ�����������ɴ�������֬�Ļ�ѧ����ʽΪ ����5���������������ٱ��Ķ�ȡ�������� ����FeCl3��Һ����ɫ��˵�������ǻ��� �ۿɷ�����ȥ��Ӧ�����Է����������뻥Ϊͬ���칹�壬�����ϵ�ȡ����Ϊ-OH��-CH2CH2OH����-OH��-��CH3��CHOH��ÿһ�������ڼ�Ը����֣����Է���������ͬ���칹����6 ������6������������Ӧԭ�����Ա�ϩΪԭ�ϣ���NBS����������CH2BrCH=CH2��CH2BrCH=CH2���巢���ӳɷ�Ӧ����CH2BrCHBrCH2Br��CH2BrCHBrCH2Br���������Ƶ�ˮ��Һ�м��ȷ�Ӧ���ϳɱ���������Ƴ������ķ�Ӧ����ͼ��CH3CH=CH2
����5���������������ٱ��Ķ�ȡ�������� ����FeCl3��Һ����ɫ��˵�������ǻ��� �ۿɷ�����ȥ��Ӧ�����Է����������뻥Ϊͬ���칹�壬�����ϵ�ȡ����Ϊ-OH��-CH2CH2OH����-OH��-��CH3��CHOH��ÿһ�������ڼ�Ը����֣����Է���������ͬ���칹����6 ������6������������Ӧԭ�����Ա�ϩΪԭ�ϣ���NBS����������CH2BrCH=CH2��CH2BrCH=CH2���巢���ӳɷ�Ӧ����CH2BrCHBrCH2Br��CH2BrCHBrCH2Br���������Ƶ�ˮ��Һ�м��ȷ�Ӧ���ϳɱ���������Ƴ������ķ�Ӧ����ͼ��CH3CH=CH2![]() CH2BrCH=CH2
CH2BrCH=CH2![]() CH2BrCHBrCH2Br
CH2BrCHBrCH2Br CH2OHCHOHCH2OH��
CH2OHCHOHCH2OH��

����Ŀ���±����л��� A��B��C��D ���й���Ϣ��
A | ����ɫ��ζ��������ˮ�� ������л������� | B | ����ʹ������Ȼ�̼��Һ��ɫ�� �ڱ���ģ��Ϊ: ������ˮ��һ�������·�Ӧ���� D |
C | ���� C��H ����Ԫ����ɣ� �����ģ��Ϊ: | D | �������Ʒ�Ӧ,�������� NaOH ��Һ��Ӧ�� ���ڴ����������ܱ������е���������Ϊ E |
���ݱ�����Ϣ�ش���������:
(1)д��B �Ľṹʽ_____��D �Ĺ�����������_____��
(2)B ��ʹ������Ȼ�̼��Һ��ɫ,��Ӧ�������������_____��
(3)B��D �Ļ�ѧ��Ӧ����Ϊ_____��
(4)D ����������E �Ļ�ѧ����ʽΪ_____��
(5)C �ķ���ʽ��_____��д����Ũ����������,C �� 50 ~60����Ũ���ᷢ����Ӧ�Ļ�ѧ����ʽ:_____��
(6)��A ��Ϊͬϵ������ʾ�����ͨʽ CnH2n+2,�� n=5 ʱ�����л�����_____��ͬ���칹��, ����̼����̵�ͬ���칹��Ľṹ��ʽ��_____��