题目内容
在一定条件下,下列反应达到平衡时,反应物的转化率均为a%,①PCl5(g)?PCl3(g)+Cl2(g) ②2HI(g)?H2(g)+I2(g)③2NO2(g)?N2O4(g)若保持各自的温度、体积不变,分别加入一定量的各自的反应物,则转化率( )
分析:若保持各自的温度、体积不变,分别加入一定量的各自的反应物,可以等效为将原来的容器缩小体积,实际上增大的反应体系的压强,根据压强对化学平衡的影响进行分析解答.
解答:解:若保持各自的温度、体积不变,分别加入一定量的各自的反应物,可以等效为将原来的容器缩小体积,实际上增大的反应体系的压强,
①该反应是一个反应前后气体体积增大的可逆反应,增大压强,平衡向逆反应方向移动,所以转化率减小;
②该反应是一个反应前后气体体积不变的可逆反应,增大压强,平衡不一定,所以转化率不变;
③该反应是一个反应前后气体体积减小的可逆反应,增大压强,平衡向正反应方向移动,所以转化率增大,
故选D.
①该反应是一个反应前后气体体积增大的可逆反应,增大压强,平衡向逆反应方向移动,所以转化率减小;
②该反应是一个反应前后气体体积不变的可逆反应,增大压强,平衡不一定,所以转化率不变;
③该反应是一个反应前后气体体积减小的可逆反应,增大压强,平衡向正反应方向移动,所以转化率增大,
故选D.
点评:本题考查了外界条件对化学平衡的影响,利用等效平衡把改变物质的浓度转化为压强,根据压强对化学平衡的影响来分析解答较简便,难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
烯烃在一定条件下发生氧化反应时,C=C双键发生断裂,RCH=CHR'可以氧化成RCHO和R'CHO.在该条件下,下列烯烃分别被氧化后,产物中可能有乙醛的是( )
| A、CH3CH=CH(CH2)2CH3 | B、CH2=CH(CH2)3CH3 | C、CH3CH=CHCH=CHCH3 | D、CH3CH2CH=CHCH2CH3 |
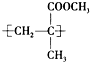 (2009?成都一模)一种有机玻璃的结构简式如图所示.下列关于它的叙述不正确的是( )
(2009?成都一模)一种有机玻璃的结构简式如图所示.下列关于它的叙述不正确的是( )