题目内容
已知难溶性的硫酸铅与醋酸铵溶液反应得到无色澄清溶液,反应的离子方程式是PbSO4+2CH3COO-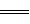 (CH3COO)2Pb+
(CH3COO)2Pb+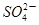 ,据此判断醋酸铅是
,据此判断醋酸铅是
| A.易溶强电解质 | B.易溶弱电解质 | C.难溶强电解质 | D.难溶弱电解质 |
B
解析PbSO4+2CH3COONH4 (CH3COO)2Pb+(NH4)2SO4属于复分解反应,使其反应至少需要满足下列三个条件中的一个:有难溶性物质(如沉淀)、挥发性物质(如气体)、难电离物质(如水)。(NH4) 2SO4是可溶性盐,(CH3COO)2Pb是无色澄清溶液,所以(CH3COO)2Pb必定是难电离物质,即弱电解质,在书写离子方程式时应保留化学式的形式。选B。
(CH3COO)2Pb+(NH4)2SO4属于复分解反应,使其反应至少需要满足下列三个条件中的一个:有难溶性物质(如沉淀)、挥发性物质(如气体)、难电离物质(如水)。(NH4) 2SO4是可溶性盐,(CH3COO)2Pb是无色澄清溶液,所以(CH3COO)2Pb必定是难电离物质,即弱电解质,在书写离子方程式时应保留化学式的形式。选B。

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
已知难溶性的硫酸铅与醋酸铵溶液反应得到无色澄清溶液,反应的离子方程式是PbSO4+2CH3COO-═(CH3COO)2Pb+S
,据此判断醋酸铅是( )
| O | 2- 4 |
| A、易溶强电解质 |
| B、易溶弱电解质 |
| C、难溶强电解质 |
| D、难溶弱电解质 |
 (CH3COO)2Pb+
(CH3COO)2Pb+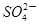 ,据此判断醋酸铅是
,据此判断醋酸铅是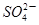 ,据此判断醋酸铅是
,据此判断醋酸铅是