题目内容
关于下列粒子的描述不正确的是( )
A、PH3的电子式为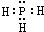 ,其热稳定性不如NH3 ,其热稳定性不如NH3 | B、HS-的电子式为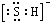 ,是含有极性键的18电子的粒子 ,是含有极性键的18电子的粒子 | C、CH2Cl2的电子式为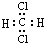 ,是分子结构呈四面体的分子 ,是分子结构呈四面体的分子 | D、KF的电子式为K+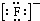 ,它是易溶于水的离子化合物 ,它是易溶于水的离子化合物 |
分析:A、磷化氢为共价化合物,根据非金属性判断氨气和磷化氢的稳定性;
B、硫氢根离子中硫离子核外达到18电子,硫氢键为极性共价键;
C、CH2Cl2的电子式中氯原子核外电子为8,没有标出另外3对孤对电子;
D、氟化钾为离子化合物,根据离子化合物的表示方法及氟化钾的水溶性判断.
B、硫氢根离子中硫离子核外达到18电子,硫氢键为极性共价键;
C、CH2Cl2的电子式中氯原子核外电子为8,没有标出另外3对孤对电子;
D、氟化钾为离子化合物,根据离子化合物的表示方法及氟化钾的水溶性判断.
解答:解:A、PH3为共价化合物,其电子式为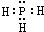 ;由于非金属性N>P,所以磷化氢的热稳定性不如NH3,故A正确;
;由于非金属性N>P,所以磷化氢的热稳定性不如NH3,故A正确;
B、HS-中硫原子核外达到8电子稳定结构,其电子式为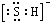 ,离子中硫氢键为极性共价键,硫氢根离子为18电子的粒子,故B正确;
,离子中硫氢键为极性共价键,硫氢根离子为18电子的粒子,故B正确;
C、CH2Cl2为共价化合物,其电子式为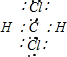 ,是分子结构呈四面体的分子,故C错误;
,是分子结构呈四面体的分子,故C错误;
D、氟化钾为离子化合物,电子式中需要标出离子所带的电荷,其电子式为:K+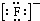 ,氟化钾易溶于水,故D正确;
,氟化钾易溶于水,故D正确;
故选C.
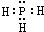 ;由于非金属性N>P,所以磷化氢的热稳定性不如NH3,故A正确;
;由于非金属性N>P,所以磷化氢的热稳定性不如NH3,故A正确;B、HS-中硫原子核外达到8电子稳定结构,其电子式为
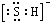 ,离子中硫氢键为极性共价键,硫氢根离子为18电子的粒子,故B正确;
,离子中硫氢键为极性共价键,硫氢根离子为18电子的粒子,故B正确;C、CH2Cl2为共价化合物,其电子式为
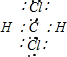 ,是分子结构呈四面体的分子,故C错误;
,是分子结构呈四面体的分子,故C错误;D、氟化钾为离子化合物,电子式中需要标出离子所带的电荷,其电子式为:K+
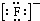 ,氟化钾易溶于水,故D正确;
,氟化钾易溶于水,故D正确;故选C.
点评:本题考查了电子式书写、化学键极性判断、元素周期律等知识,题目难度中等,注意掌握离子化合物、共价化合物的电子式表示方法,该题是高考中的常见题型与重要的考点,该题基础性强,难易适中,主要是考查学生对常见化学用语的熟悉掌握程度,该类试题需要明确的是常见的化学用语.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
|
关于下列粒子的描述不正确的是 | |
| [ ] | |
A. |
PH3的电子式为 |
B. |
HS-的电子式为 |
C. |
CH2Cl2的电子式为 |
D. |
KF的电子式为K+ |
关于下列粒子的描述不正确的是
A.PH3的电子式为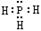 ,其热稳定性不如NH3 ,其热稳定性不如NH3 |
B.HS-的电子式为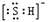 ,是含有极性键的18电子的粒子 ,是含有极性键的18电子的粒子 |
C.CH2Cl2的电子式为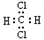 ,是结构呈正四面体的分子 ,是结构呈正四面体的分子 |
D.KF的电子式为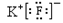 ,它是易溶于水的离子化合物 ,它是易溶于水的离子化合物 |
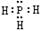 ,其热稳定性不如NH3
,其热稳定性不如NH3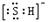 ,是含有极性键的18电子的粒子
,是含有极性键的18电子的粒子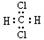 ,是结构呈正四面体的分子
,是结构呈正四面体的分子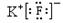 ,它是易溶于水的离子化合物
,它是易溶于水的离子化合物