题目内容
在实验室里鉴定氯酸钾晶体和1氯丙烷中的氯元素,现设计了下列实验操作程序:①滴加AgNO3溶液;②加入NaOH溶液;③加热;④加入MnO2固体;⑤加蒸馏水过滤后取滤液;⑥过滤后取滤渣;⑦用稀HNO3酸化。
(1)鉴定氯酸钾晶体中氯元素的操作步骤是__________(填序号)。
(2)鉴定1氯丙烷中氯元素的操作步骤是________(填序号)。
解析 要鉴定样品中是否含有氯元素,通常先将样品中的氯元素转化为Cl-,再使Cl-转化为AgCl沉淀,利用沉淀的颜色和不溶于稀HNO3的性质来判断氯元素的存在。
(1)鉴定氯酸钾晶体中的氯元素,可先转化成氯化钾,再利用硝酸酸化的AgNO3溶液来检验Cl-。
(2)鉴定1氯丙烷中的氯元素,必须先将1氯丙烷中的氯原子通过水解或消去反应变为氯离子,再滴入硝酸酸化的AgNO3溶液来检验。即先取少量1氯丙烷加入NaOH的水溶液,使其水解后,再加入稀HNO3,然后加入AgNO3溶液,观察沉淀的颜色来判断是否是氯元素。其实验的关键是在加入AgNO3溶液之前,应加入稀HNO3酸化,以中和过量的NaOH溶液,防止NaOH与AgNO3溶液反应生成的沉淀对实验的观察产生干扰。
答案 (1)④③⑤⑦① (2)②③⑦①

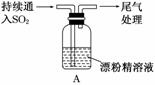
某学生对SO2与漂粉精的反应进行实验探究:
| 操作 | 现象 |
| 取4 g漂粉精固体,加入100 mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
|
| i.液面上方出现白雾; ii.稍后,出现浑浊,溶液变为黄绿色;iii.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是 ________________________________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是__________________________。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成。进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
① 实验a的目的是______________________________________________________。
②由实验a、b不能判断白雾中含有HCl,理由是________________________________。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是_____________________。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HCl,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀。则沉淀X中含有的物质是________。
②用离子方程式解释现象iii中黄绿色褪去的原因:______________________________
________________________________________________________________________。
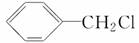 ②CH3CH2CH2Br ③CH3F
②CH3CH2CH2Br ③CH3F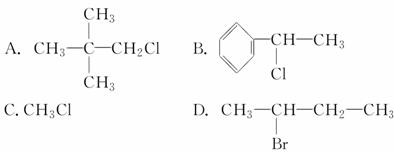
 D.
D.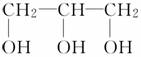
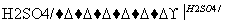 C4H8(乙)
C4H8(乙)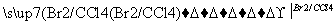 C4H8Br2(丙)。
C4H8Br2(丙)。