题目内容
尿素(H2NCONH2)是一种非常重要的高氮化肥.在工农业生产中有着非常重要的地位.工业上合成尿素的反应如下:
2NH3(g)+CO2(g)?H2O(g)+H2NCONH(g)△H=-103.7kJ.mol
(1)在温度70~95℃时,工业尾气中的NO、NO2可以尿素溶液吸收,将其转化为N2
①尿素与NO、NO2三者等物质的量反应,化学方程式为 .
②已知:N2(g)+O2(g)═2NO(g)△H=180.6kJ?mol-1
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H=483.6kJ?mol-1
则4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H= .
(2)某实验小组模拟工业上合成尿素的条件.在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L,的密闭容器中经20miri达到平衡,各物质浓度的变化曲线如图所示.
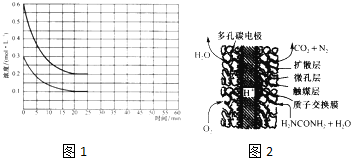
①在上述条件下,从反应开始至20min时.二氧化碳的平均反应速率为 .
②该反应的平衡常数K= ;若升高体系的温度,容器中NH3的体积分数将 (填“增加”、“减小”或“不变”).
③若保持平衡的温度和压强不变,再向容器中充入3mol的氨气,则此时v正 v逆(填“>”“=”或“<”),判断理由 .
(3)尿素燃料电池结构如图所示.其工作时负极电极反应式可表示为 .
2NH3(g)+CO2(g)?H2O(g)+H2NCONH(g)△H=-103.7kJ.mol
(1)在温度70~95℃时,工业尾气中的NO、NO2可以尿素溶液吸收,将其转化为N2
①尿素与NO、NO2三者等物质的量反应,化学方程式为
②已知:N2(g)+O2(g)═2NO(g)△H=180.6kJ?mol-1
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H=483.6kJ?mol-1
则4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=
(2)某实验小组模拟工业上合成尿素的条件.在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L,的密闭容器中经20miri达到平衡,各物质浓度的变化曲线如图所示.

①在上述条件下,从反应开始至20min时.二氧化碳的平均反应速率为
②该反应的平衡常数K=
③若保持平衡的温度和压强不变,再向容器中充入3mol的氨气,则此时v正
(3)尿素燃料电池结构如图所示.其工作时负极电极反应式可表示为
分析:(1)①尿素与NO、NO2三者等物质的量反应生成二氧化碳、氮气和水;
②依据热化学方程式和盖斯定律计算;
(2)①由图可知,20min时达平衡,二氧化碳的浓度变化量为0.3mol/L-0.1mol/L=0.2mol/L,根据v=
计算;
②根据三段式计算平衡时各组分的浓度,代入平衡常数表达式计算;
该反应正反应是放热反应,升高温度,平衡向逆反应方向移动,氨气的体积分数增大;
③再向容器中充入3mol的氨气,浓度商大于化学平衡常数,平衡向正反应方向移动;
(3)尿素燃料电池依据原电池原理,燃料在负极发生氧化反应,氧气再正极得到电子发生还原反应;结合图中生成产物写出电极反应.
②依据热化学方程式和盖斯定律计算;
(2)①由图可知,20min时达平衡,二氧化碳的浓度变化量为0.3mol/L-0.1mol/L=0.2mol/L,根据v=
| △c |
| △t |
②根据三段式计算平衡时各组分的浓度,代入平衡常数表达式计算;
该反应正反应是放热反应,升高温度,平衡向逆反应方向移动,氨气的体积分数增大;
③再向容器中充入3mol的氨气,浓度商大于化学平衡常数,平衡向正反应方向移动;
(3)尿素燃料电池依据原电池原理,燃料在负极发生氧化反应,氧气再正极得到电子发生还原反应;结合图中生成产物写出电极反应.
解答:解:(1)①工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2,尿素与NO、NO2三者等物质的量反应,生成二氧化碳、氮气和水,反应的化学方程式为:CO(NH2)2+NO+NO2=CO2+2N2+2H2O,
故答案为:CO(NH2)2+NO+NO2=CO2+2N2+2H2O;
②a、N2(g)+O2(g)═2NO(g).△H=180.6kJ?mol-1
b、N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1
c、2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
依据盖斯定律c×3-2×b-2×a得到,4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=-1627.2KJ/mol,
故答案为:-1627.2KJ/mol;
(2)①由图可知,20min时达平衡,二氧化碳的浓度变化量为0.3mol/L-0.1mol/L=0.2mol/L,故v(CO2)=
=0.01mol/(L?min),
故答案为:0.01mol/(L?min);
②20min时达平衡,二氧化碳的浓度变化量为0.1mol/L,则:
2NH3(g)+CO2(g)?H2O(g)+CO(NH2)2(g)
开始(mol/L):0.6 0.3 0 0
变化(mol/L):0.4 0.2 0.2 0.2
平衡(mol/L):0.2 0.1 0.2 0.2
故该温度下平衡常数k=
=10
该反应正反应是放热反应,升高温度,平衡向逆反应方向移动,氨气的体积分数增大,
故答案为:10;增加;
③再向容器中充入3mol的氨气,氨气的浓度增大,浓度商大于化学平衡常数,平衡向正反应方向移动,故v正>v逆,
故答案为:>;氨气的浓度增大,浓度商大于化学平衡常数,平衡向正反应方向移动;
(3)依据尿素燃料电池结构,尿素在负极发生氧化反应失电子生成二氧化碳和氮气,氧气在正极得到电子发生还原反应生成氢氧根离子,酸性介质中实际生成水,正极电极反应为O2+4H++4e-=2H2O,负极电极反应为:CO(NH2)2+H2O-6e-=CO2+N2+6H+;
故答案为:CO(NH2)2+H2O-6e-=CO2+N2+6H+.
故答案为:CO(NH2)2+NO+NO2=CO2+2N2+2H2O;
②a、N2(g)+O2(g)═2NO(g).△H=180.6kJ?mol-1
b、N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1
c、2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
依据盖斯定律c×3-2×b-2×a得到,4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=-1627.2KJ/mol,
故答案为:-1627.2KJ/mol;
(2)①由图可知,20min时达平衡,二氧化碳的浓度变化量为0.3mol/L-0.1mol/L=0.2mol/L,故v(CO2)=
| 0.2mol/L |
| 20min |
故答案为:0.01mol/(L?min);
②20min时达平衡,二氧化碳的浓度变化量为0.1mol/L,则:
2NH3(g)+CO2(g)?H2O(g)+CO(NH2)2(g)
开始(mol/L):0.6 0.3 0 0
变化(mol/L):0.4 0.2 0.2 0.2
平衡(mol/L):0.2 0.1 0.2 0.2
故该温度下平衡常数k=
| 0.2×0.2 |
| 0.22×0.1 |
该反应正反应是放热反应,升高温度,平衡向逆反应方向移动,氨气的体积分数增大,
故答案为:10;增加;
③再向容器中充入3mol的氨气,氨气的浓度增大,浓度商大于化学平衡常数,平衡向正反应方向移动,故v正>v逆,
故答案为:>;氨气的浓度增大,浓度商大于化学平衡常数,平衡向正反应方向移动;
(3)依据尿素燃料电池结构,尿素在负极发生氧化反应失电子生成二氧化碳和氮气,氧气在正极得到电子发生还原反应生成氢氧根离子,酸性介质中实际生成水,正极电极反应为O2+4H++4e-=2H2O,负极电极反应为:CO(NH2)2+H2O-6e-=CO2+N2+6H+;
故答案为:CO(NH2)2+H2O-6e-=CO2+N2+6H+.
点评:本题考查反应热的计算、化学反应速率计算、化学平衡的影响因素、化学平衡常数、原电池等,题目难度中等,(3)中电极反应式书写为易错点,注意根据原电池结构分析产物.

练习册系列答案
相关题目