题目内容
下列物质的制备与工业生产相符的是( )
①NH3
NO
HNO3
②浓HCl
Cl2
漂白粉
③MgCl2(aq)
无水MgCl2
Mg
④饱和NaCl(aq)
NaHCO3
Na2CO3
⑤铝土矿
NaAlO2溶液
Al(OH)3
Al2O3
Al.
①NH3
| O2 |
| H2O、O2 |
②浓HCl
| MnO2 |
| △ |
| 石灰乳 |
③MgCl2(aq)
| △ |
| 电解 |
④饱和NaCl(aq)
| NH3、CO2 |
| △ |
⑤铝土矿
| NaOH溶液 |
| 过量CO2酸化 |
| 灼烧 |
| 电解 |
| A、①④⑤ | B、①③⑤ |
| C、②③④ | D、②④⑤ |
分析:①工业上用氨气(NH3)制取硝酸(HNO3),工业流程为:4NH3+5O2
4NO+6H2O、2NO+O2=2NO2 、3NO2+H2O=2HNO3+NO;
②工业上常以食盐为原料制备氯气,再用氯气制备漂白粉:①2NaCl+2H2O
2NaOH+H2↑+Cl2↑,②2C12+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
③工业上制Mg的过程:MgC12溶液:将MgC12溶液经蒸发结晶得到MgC12?6H2O,然后MgC12?6H2O在一定条件下加热得到无水MgC12:MgCl2?6H2O
MgCl2+6H2O;最后电解熔融的氯化镁可得到Mg:MgCl2
Mg+Cl2↑;
④联合制碱法:先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液,其化学反应原理是:NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl,将经过滤、洗涤得到的NaHCO3微小晶体,再加热煅烧制得纯碱产品:2NaHCO3
Na2CO3+CO2↑+H2O;
⑤从铝土矿中提取铝反应过程 ①溶解:将铝土矿溶于NaOH(aq):Al?O?+2NaOH=2NaAlO+H?O ②过滤:除去残渣氧化亚铁(FeO)、硅铝酸钠等 ③酸化:向滤液中通入过量CO2:
NaAlO2+CO?+2H?O=Al(OH)?↓+NaHCO?④过滤、灼烧 Al(OH)?:2Al(OH)?
Al2O3+3H?O; ⑤电解:2Al2O3(l)
4Al+3O?↑.
| ||
②工业上常以食盐为原料制备氯气,再用氯气制备漂白粉:①2NaCl+2H2O
| ||
③工业上制Mg的过程:MgC12溶液:将MgC12溶液经蒸发结晶得到MgC12?6H2O,然后MgC12?6H2O在一定条件下加热得到无水MgC12:MgCl2?6H2O
| ||
| ||
④联合制碱法:先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液,其化学反应原理是:NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl,将经过滤、洗涤得到的NaHCO3微小晶体,再加热煅烧制得纯碱产品:2NaHCO3
| ||
⑤从铝土矿中提取铝反应过程 ①溶解:将铝土矿溶于NaOH(aq):Al?O?+2NaOH=2NaAlO+H?O ②过滤:除去残渣氧化亚铁(FeO)、硅铝酸钠等 ③酸化:向滤液中通入过量CO2:
NaAlO2+CO?+2H?O=Al(OH)?↓+NaHCO?④过滤、灼烧 Al(OH)?:2Al(OH)?
| ||
| ||
解答:解:①工业上用氨气(NH3)制取硝酸(HNO3)的工业流程:NH3
NO
HNO3,故①正确;
②工业上制备漂白粉的工业流程:①NaCl溶液
Cl2
漂白粉,故②错误;
③工业上制Mg的工业流程:MgC12溶液:MgCl2(aq)
MgC12?6H2O
无水MgCl2
Mg,故③错误;
④联合制碱法的工业流程:饱和NaCl(aq)
NaHCO3
Na2CO3,故④正确;
⑤从铝土矿中提取铝的工业流程:铝土矿
NaAlO2溶液
Al(OH)3
Al2O3
Al,故⑤正确;
故选A.
| O2 |
| H2O、O2 |
②工业上制备漂白粉的工业流程:①NaCl溶液
| 通电 |
| 石灰乳 |
③工业上制Mg的工业流程:MgC12溶液:MgCl2(aq)
| 蒸发结晶 |
| 氯化氢 |
| 电解 |
④联合制碱法的工业流程:饱和NaCl(aq)
| NH3、CO2 |
| △ |
⑤从铝土矿中提取铝的工业流程:铝土矿
| NaOH溶液 |
| 过量CO2酸化 |
| 灼烧 |
| 电解 |
故选A.
点评:本题主要考查了物质的工业制备,掌握制备的原理是解题的关键,难度不大.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
 NO
NO  HNO3
HNO3 Cl2
Cl2  漂白粉
漂白粉 无水MgCl2
无水MgCl2  Mg
Mg NaHCO3
NaHCO3  NaAlO2溶液
NaAlO2溶液 Al(OH)3
Al(OH)3 Al2O3
Al2O3 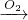 NO
NO HNO3
HNO3 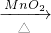 Cl2
Cl2 漂白粉
漂白粉  无水MgCl2
无水MgCl2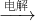 Mg
Mg 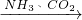 NaHCO3
NaHCO3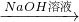 NaAlO2溶液
NaAlO2溶液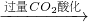 Al(OH)3
Al(OH)3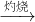 Al2O3
Al2O3