题目内容
【题目】Na2SO3固体在空气中久置容易变质。
I请写出Na2SO3固体在空气中被氧化变质的化学方程式_______________。
Ⅱ实验室中欲检验 Na2SO3 固体样品是否已经变质,最简单的方法为_____________。
Ⅲ选用以下装置和药品通过测定生成SO2的质量,可计算Na2SO3固体样品的纯度。
反应原理:H2SO4(浓)+Na2SO3=Na2SO4+SO2↑+H2O
已知碱石灰能吸收SO2
供选用的药品:①浓硫酸 ②浓硝酸 ③碱石灰 ④空气
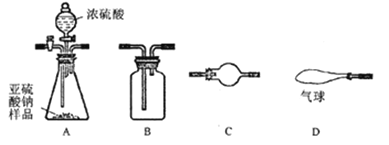
(1)将所选仪器按连接顺序从左至右依次填入下表,并对应填入该仪器中所加试剂(不用填A装置中药品;根据需要填写,可不填满)

(2)称取agNa2SO3固体样品,上述实验完成后,测得生成SO2的质量为bg,则该Na2SO3固体样品质量分数为_____________。
【答案】Ⅰ2Na2SO3+O2=2Na2SO4(2分)
Ⅱ取适量样品溶解,加人足量的盐酸酸化的氯化钡溶液,充分反应后,若有白色沉淀存在, 证明Na2SO3已经变质;若无白色沉淀,证明Na2SO3未变质。(或取适量样品溶解,先加入足量氯化钡溶液,产生白色沉淀,再加足量稀盐酸,若仍有白色沉淀存在,证明Na2SO3已经变质;若白色沉淀完全消失,证明Na2SO3未变质。)(3分)
III(1)
实验装置(填字母) | C | A | B | C | C | ||
装置中所盛药品(填序号) | ③ | ① | ③ | ③ |
(2)![]() ×100%(2分)
×100%(2分)
【解析】
试题分析:Ⅰ.亚硫酸钠固体被氧气氧化为硫酸钠,反应方程式为:2Na2SO3+O2=2Na2SO4 。
Ⅱ.Na2SO3 固体样品已经变质,说明含有硫酸根离子,所以取适量样品溶解,加入足量的盐酸酸化的氯化钡溶液,充分反应后,若有白色沉淀存在, 证明Na2SO3已经变质;若无白色沉淀,证明Na2SO3未变质。
Ⅲ.(1)通过测定生成SO2的质量,可计算Na2SO3固体样品的纯度,所以二氧化硫要全部被碱石灰吸收,但是又不能引入空气中的二氧化碳和水蒸气以及反应产生的水蒸气,所以通入空气要先除二氧化碳和水蒸气,D和A之间还应增加一个碱石灰的干燥装置,A生成二氧化硫时还要通过浓硫酸来吸收产生的水蒸气,最后还要连一个碱石灰的干燥装置防止后面的空气进入影响测定结果,答案为:
实验装置(填字母) | C | A | B | C | C | ||
装置中所盛药品(填序号) | ③ | ① | ③ | ③ |
(2)根据硫守恒,则亚硫酸钠的质量为b÷64g/mol×126g/mol=63b/32 g,所以Na2SO3固体祥品的质量分数为(63b÷32g)÷ag×100%=![]() ×100%。
×100%。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案