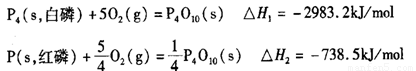题目内容
科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的。”利用盖斯定律可测某些特殊反应的热效应。?(1)P4(s,白磷)+5O2(g) ![]() P4O10 (s) ΔH=-2 983.2 kJ·mol-1??
P4O10 (s) ΔH=-2 983.2 kJ·mol-1??
(2)P(s,红磷)+![]() O2(g)
O2(g)![]()
![]() P4O10(s) ΔH2=-738.5 kJ·mol-1??
P4O10(s) ΔH2=-738.5 kJ·mol-1??
则白磷转化为红磷的热化学方程式? ?。相同的状况下,能量较低的是 ;白磷的稳定性比红磷? ?(填“高”或“低”)。?
解析:依题意求:P4(s,白磷) ![]() 4P(s,红磷) ΔH=?可设计如下反应过程:P4(s,白磷)
4P(s,红磷) ΔH=?可设计如下反应过程:P4(s,白磷) ![]() P4O10
P4O10![]() 4P(s,红磷);据盖斯定律有ΔH=ΔH1+(-)4ΔH2=(-2 983.2+4×738.5)kJ·mol-1=-29.2 kJ·mol-1,即P4(s,白磷)
4P(s,红磷);据盖斯定律有ΔH=ΔH1+(-)4ΔH2=(-2 983.2+4×738.5)kJ·mol-1=-29.2 kJ·mol-1,即P4(s,白磷) ![]() 4P(s,红磷) ΔH=-29.2 kJ·mol-1。白磷转化为红磷是放热反应,稳定性比红磷低(能量越低越稳定)。?
4P(s,红磷) ΔH=-29.2 kJ·mol-1。白磷转化为红磷是放热反应,稳定性比红磷低(能量越低越稳定)。?
答案:P4(s,白磷) ![]() 4P(s,红磷) ΔH=-29.2 kJ·mol-1 红磷 低
4P(s,红磷) ΔH=-29.2 kJ·mol-1 红磷 低

练习册系列答案
相关题目
 键分别需要的能是436kJ、39lkJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。
键分别需要的能是436kJ、39lkJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。