题目内容
 (1)我国材料科学家师昌绪在合金钢、高温合金及材料强度的研究领域作出杰出贡献,荣获2010年度国家最高科学技术奖.
(1)我国材料科学家师昌绪在合金钢、高温合金及材料强度的研究领域作出杰出贡献,荣获2010年度国家最高科学技术奖.①汽车尾气(含有烃类、CO、SO2与NO等物质)治理的方法之一是在汽车的排气管上装一个用铂、钯合金作催化剂的催化转换器.它的特点是使CO与NO反应,生成无毒气体,并促使烃类充分燃烧及SO2的转化.写出CO与NO反应的化学方程式:
2NO+2CO
N2+2CO2
| ||
2NO+2CO
N2+2CO2
.
| ||
②钢铁是人们生活中常用的金属材料,也是一种合金.如图所示,钢铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)
Ⅰ>Ⅲ>Ⅱ
Ⅰ>Ⅲ>Ⅱ
.(2)经研究,光化学烟雾的有害物质中含有臭氧,其形成过程与二氧化氮有关,这个过程实际上包含了三个反应:
①NO2
| ||
3O2
2O3
| ||
3O2
2O3
,NO2在其中起了
| ||
催化
催化
作用.分析:(1)①根据CO与NO反应,生成无毒气体为氮气和二氧化碳书写方程式;
②金属作原电池负极的金属加速腐蚀,金属作原电池正极的金属被保护,电化学腐蚀速率大于化学腐蚀;
(2)将方程式①×2+②+③×2得总方程式,二氧化氮的作用为催化剂;
②金属作原电池负极的金属加速腐蚀,金属作原电池正极的金属被保护,电化学腐蚀速率大于化学腐蚀;
(2)将方程式①×2+②+③×2得总方程式,二氧化氮的作用为催化剂;
解答:解:(1)①由信息可知,“催化转换器”使CO与NO反应,生成无毒气体为氮气和二氧化碳,该反应为:2NO+2CO
N2+2CO2;
故答案为:2NO+2CO
N2+2CO2;
②I中碳和铁、电解质溶液构成原电池,碳作正极,铁作负极而加速被腐蚀,II中铁、锌和电解质溶液构成原电池,锌作负极,铁作正极而被保护,Ⅲ中发生化学腐蚀,电化学腐蚀速率大于化学腐蚀,所以铁被腐蚀的速率由大到小的顺序是:Ⅰ>Ⅲ>Ⅱ,
故答案为:Ⅰ>Ⅲ>Ⅱ;
(2)将方程式①×2+②+③×2得总方程式为3O2═2O3,在方程式①二氧化氮是反应物,在方程式②中二氧化氮 生成物,在总反应方程式中没有二氧化氮,所以二氧化氮起催化剂作用,
故答案为:3O2
2O3;催化;
| ||
故答案为:2NO+2CO
| ||
②I中碳和铁、电解质溶液构成原电池,碳作正极,铁作负极而加速被腐蚀,II中铁、锌和电解质溶液构成原电池,锌作负极,铁作正极而被保护,Ⅲ中发生化学腐蚀,电化学腐蚀速率大于化学腐蚀,所以铁被腐蚀的速率由大到小的顺序是:Ⅰ>Ⅲ>Ⅱ,
故答案为:Ⅰ>Ⅲ>Ⅱ;
(2)将方程式①×2+②+③×2得总方程式为3O2═2O3,在方程式①二氧化氮是反应物,在方程式②中二氧化氮 生成物,在总反应方程式中没有二氧化氮,所以二氧化氮起催化剂作用,
故答案为:3O2
| ||
点评:本题考查了环境污染、原电池原理等知识,学生能运用化学知识解决生产生活问题,难度不大.

练习册系列答案
相关题目


 ,它是一种水溶性的维生素,缺乏VC会使人患上坏血病.切取一片新鲜水果,向切面上滴加淀粉和碘水的混合溶液,会发现混合溶液蓝色褪去,这说明新鲜水果中的VC具有
,它是一种水溶性的维生素,缺乏VC会使人患上坏血病.切取一片新鲜水果,向切面上滴加淀粉和碘水的混合溶液,会发现混合溶液蓝色褪去,这说明新鲜水果中的VC具有

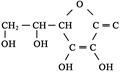 ,它是一种水溶性的维生素,缺乏VC会使人患上坏血病。切取一片新鲜水果,向切面上滴加淀粉和碘水的混合溶液,会发现混合溶液蓝色褪去,这说明新鲜水果中的VC具有____________(填“氧化”或“还原”)性质。
,它是一种水溶性的维生素,缺乏VC会使人患上坏血病。切取一片新鲜水果,向切面上滴加淀粉和碘水的混合溶液,会发现混合溶液蓝色褪去,这说明新鲜水果中的VC具有____________(填“氧化”或“还原”)性质。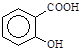 )可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解。写出水杨酸与小苏打反应的化学方程式: 。
)可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解。写出水杨酸与小苏打反应的化学方程式: 。
 ,它是一种水溶性的维生素,缺乏VC会使人患上坏血病。切取一片新鲜水果,向切面上滴加淀粉和碘水的混合溶液,会发现混合溶液蓝色褪去,这说明新鲜水果中的VC具有____________(填“氧化”或“还原”)性质。
,它是一种水溶性的维生素,缺乏VC会使人患上坏血病。切取一片新鲜水果,向切面上滴加淀粉和碘水的混合溶液,会发现混合溶液蓝色褪去,这说明新鲜水果中的VC具有____________(填“氧化”或“还原”)性质。 )可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解。写出水杨酸与小苏打反应的化学方程式:
。
)可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解。写出水杨酸与小苏打反应的化学方程式:
。