题目内容
下列事实能说明氯的非金属性比硫强的是( )
| A、次氯酸的酸性比硫酸弱 | B、氯气能置换氢硫酸(H2S的水溶液)中的硫 | C、氢硫酸是弱酸,而盐酸是强酸 | D、硫在常温下为固态,而氯气为气态 |
分析:A、非金属性越强,最高价氧化物的水化物的酸性越强;
B、非金属性强的能置换非金属性弱的;
C、非金属性越强,氢化物的稳定性越强,但是不能根据氢化物的酸性判断非金属性;
D、元素的非金属性与单质的状态无关.
B、非金属性强的能置换非金属性弱的;
C、非金属性越强,氢化物的稳定性越强,但是不能根据氢化物的酸性判断非金属性;
D、元素的非金属性与单质的状态无关.
解答:解:A、非金属性越强,最高价氧化物的水化物的酸性越强,但是次氯酸不是氯元素的最高价氧化物的水化物,所以不说明氯的非金属性比硫强,故A不选;
B、非金属性强的能置换非金属性弱的,氯气通入H2S溶液中,溶液有浅黄色混浊,能说明氯的非金属性比硫强,故B选;
C、非金属性越强,氢化物的稳定性越强,但是不能根据氢化物的酸性判断非金属性,所以不能根据氢硫酸是弱酸,而盐酸是强酸,判断非金属性的强弱,故C不选;
D、元素的非金属性与单质的状态无关,所以不能根据硫在常温下为固态,而氯气为气态,判断非金属性的强弱,故D不选;
故选B.
B、非金属性强的能置换非金属性弱的,氯气通入H2S溶液中,溶液有浅黄色混浊,能说明氯的非金属性比硫强,故B选;
C、非金属性越强,氢化物的稳定性越强,但是不能根据氢化物的酸性判断非金属性,所以不能根据氢硫酸是弱酸,而盐酸是强酸,判断非金属性的强弱,故C不选;
D、元素的非金属性与单质的状态无关,所以不能根据硫在常温下为固态,而氯气为气态,判断非金属性的强弱,故D不选;
故选B.
点评:本题考查了非金属性强弱比较,解决该题的关键是明确非金属性强弱比较的判断依据,然后结合题意灵活运用即可,有利于培养学生的逻辑推理能力和创新思维能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
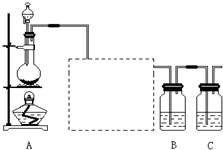 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:


 证氯元素的非金属性比硫元素的
证氯元素的非金属性比硫元素的