题目内容
将4 mol SO3气体和4 mol NO置于2 L容器中,在一定条件下发生如下可逆反应(不考虑NO2和N2O4之间的相互转化):
2SO3(g)![]() 2SO2+O2;2NO+O2
2SO2+O2;2NO+O2![]() 2NO2。
2NO2。
(1)当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)=0.1 mol、n(NO2)=3.6 mol,则此时SO3气体的物质的量是多少?(写出计算过程)
(2)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和______,或NO和________(填分子式)。
(3)若在另外一个2 L的容器中只发生反应2NO+O2![]() 2NO2,其中NO、O2、NO2的起始浓度依次是0.2 mol?L-1、0.1 mol?L-1、0.2 mol?L-1,当反应达到平衡时,各物质的浓度可能是________(选填字母代号)。
2NO2,其中NO、O2、NO2的起始浓度依次是0.2 mol?L-1、0.1 mol?L-1、0.2 mol?L-1,当反应达到平衡时,各物质的浓度可能是________(选填字母代号)。
A.c(NO)=0.35 mol?L-1或c(NO)=0.09 mol?L-1
B.c(NO2)=0.4 mol?L-1
C.c(NO2)=0.35 mol?L-1
D.c(O2)=0.2 mol?L-1或c(NO)=0.4 mol?L-1
(1)0.2 mol (2)SO2、NO2 (3)A、C

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
 2SO2+O2?2NO+O2
2SO2+O2?2NO+O2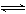 2SO2+O2?2NO+O2
2SO2+O2?2NO+O2