题目内容
【题目】(1)有一种新型的高能电池—钠硫电池(熔融的钠、硫为两极,以Na+导电的βAl2O3陶瓷作固体电解质),反应式为2Na+xS![]() Na2Sx。
Na2Sx。

①充电时,钠极与外电源________(填“正”或“负”)极相连。其阳极反应式:_______________________________________。
②放电时,发生还原反应的是__________(填“钠”或“硫”)极。
③用该电池作电源电解(如上图)NaCl溶液(足量),写出电解NaCl溶液的离子方程式:________________________________,若钠硫电池工作一段时间后消耗23 g Na (电能的损耗忽略不计),若要使溶液完全恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入(或通入)________(填物质名称),其质量约为_____________________________________。
④若用该钠硫电池作电源在一铁片上镀铜,此铁片与__________(填“钠”或“硫”)极相连。
(2)某原电池装置如下图所示,电池总反应为2Ag+Cl2===2AgCl。
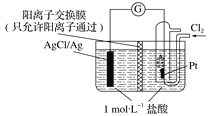
①放电时,交换膜左侧溶液中实验现象____________________。
②当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少__________ mol离子。
③该电池的能量转化的主要形式为_________________________________________________。
【答案】 负 Na2Sx-2e-===xS+2Na+ (或S![]() -2e-===xS) 硫 2Cl-+ 2H2O
-2e-===xS) 硫 2Cl-+ 2H2O![]() 2OH-+H2↑+ Cl2↑ 氯化氢 36.5 g 钠 有大量白色沉淀生成 0.02 化学能转化为电能
2OH-+H2↑+ Cl2↑ 氯化氢 36.5 g 钠 有大量白色沉淀生成 0.02 化学能转化为电能
【解析】(1)①根据电池反应式知,充电时,钠离子得电子发生还原反应,所以钠作阴极,应该连接电源负极;阴极上失电子发生氧化反应,电极反应式为Na2Sx-2e-=xS+2Na+或Sx2--2e-=xS,故答案为:负;Na2Sx-2e-=xS+2Na+或Sx2--2e-=xS;
②放电时,硫得电子发生还原反应作正极,故答案为:硫;
③电解NaCl溶液生成氢气、氯气和氢氧化钠,离子方程式为:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑,电解本质为电解HCl,根据少什么加什么结合转移电子数相等,所以若要使溶液完全恢复到起始浓度,可向溶液中加入氯化氢,其质量约为
2OH-+H2↑+Cl2↑,电解本质为电解HCl,根据少什么加什么结合转移电子数相等,所以若要使溶液完全恢复到起始浓度,可向溶液中加入氯化氢,其质量约为![]() ×36.5g/mol=36.5g,故答案为:2Cl-+2H2O
×36.5g/mol=36.5g,故答案为:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;氯化氢;36.5g;
2OH-+H2↑+Cl2↑;氯化氢;36.5g;
④在一铁片上镀铜,铜作阳极,铁作阴极应与负极相连,所以若用该钠硫电池作电源在一铁片上镀铜,此铁片与负极钠相连,故答案为:钠;
(2)①放电时,交换膜左侧的氢离子向右侧移动,在负极上有银离子生成,银离子在左侧和氯离子反应生成AgCl沉淀,故答案为:有大量白色沉淀生成;
②放电时,当电路中转移0.01mol e-时,交换膜左则会有0.01mol氢离子通过阳离子交换膜向正极移动,有0.01mol氯离子反应生成AgCl白色沉淀,所以交换膜左侧溶液中约减少0.02 mol离子,故答案为:0.02;
③该电池的能量转化的主要形式为化学能转化为电能,故答案为:化学能转化为电能。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案