题目内容
【题目】A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如右(部分反应中的水已略去). 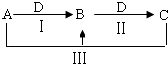
(1)若A为氯碱工业的产品,C为厨房中的用品.
①D的电子式是 .
②反应Ⅲ的离子方程式是 .
③氯碱工业制备A的化学方程式是 , 其中两种产物可与KI溶液反应制得一种化工原料,若消耗0.1mol KI转移电子0.6mol,则三种物质间反应的离子方程式是 .
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料.
①反应Ⅲ的离子方程式是 .
②B可作净水剂,在使用时发现B不能使酸性废水中的悬浮物沉降除去,其原因是 .
【答案】
(1)![]() ;HCO3﹣+OH﹣=H2O+CO32﹣;2NaCl+2H2
;HCO3﹣+OH﹣=H2O+CO32﹣;2NaCl+2H2 ![]() 2NaOH+H2↑+Cl2↑;3Cl2+6OH﹣+I﹣=6Cl﹣+IO3﹣+3H2O
2NaOH+H2↑+Cl2↑;3Cl2+6OH﹣+I﹣=6Cl﹣+IO3﹣+3H2O
(2)Cl2+2Fe2+=2Cl﹣+2Fe3+;Fe3++3H2O?Fe(OH)3+3H+ , 酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体
【解析】解:(1.)氯碱工业的产品为氢氧化钠、氢气和氯气,且A可生成C,C为厨房中用品,A和C反应生成B,A、B、C含有同一种元素,所以A为氢氧化钠,C为碳酸氢钠,B为碳酸钠,D为二氧化碳;①二氧化碳中C的最外层只有四个电子,与氧形成四对共用电子对,达到稳定结构,电子式为: ![]() ;②反应Ⅲ为氢氧化钠和碳酸氢钠反应生成碳酸钠和水,根据离子方程式的书写方法可知该反应的离子方程式为:HCO3﹣+OH﹣=H2O+CO32﹣;③氯碱工业中制备A的化学方程式为:2NaCl+2H2
;②反应Ⅲ为氢氧化钠和碳酸氢钠反应生成碳酸钠和水,根据离子方程式的书写方法可知该反应的离子方程式为:HCO3﹣+OH﹣=H2O+CO32﹣;③氯碱工业中制备A的化学方程式为:2NaCl+2H2 ![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
Cl2具有强氧化性,I﹣具有还原性,该反应中消耗0.1mol KI转移电子0.6mol电子,则碘的化合价由﹣1价升高到+5价,碘化钾转化为碘酸钾,氯气做氧化剂,化合价由0价降低到﹣1价,反应的离子方程式为:3Cl2+6OH﹣+I﹣=6Cl﹣+IO3﹣+3H2O;
(2.)D为单质且D元素的一种红棕色氧化物常用作颜料,所以D为铁;A为气体单质,与铁反应生成B,B和铁反应生成C,A和铁反应生成B,所以A为氯气,B为氯化铁,C为氯化亚铁;①反应Ⅲ为氯气和氯化亚铁反应生成氯化铁,反应的离子方程式为:Cl2+2Fe2+=2Cl﹣+2Fe3+;②氯化铁为强酸弱碱盐,在水中发生水解Fe3++3H2OFe(OH)3+3H+ , 生成氢氧化铁胶体,可起到净水作用,在酸性条件下,抑制了酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体,
不能使酸性废水中的悬浮物沉降除去.
所以答案是:(1.)① ![]() ;②HCO3﹣+OH﹣=H2O+CO32﹣;③2NaCl+2H2
;②HCO3﹣+OH﹣=H2O+CO32﹣;③2NaCl+2H2 ![]() 2NaOH+H2↑+Cl2↑,3Cl2+6OH﹣+I﹣=6Cl﹣+IO3﹣+3H2O;
2NaOH+H2↑+Cl2↑,3Cl2+6OH﹣+I﹣=6Cl﹣+IO3﹣+3H2O;
(2.)①Cl2+2Fe2+=2Cl﹣+2Fe3+;②Fe3++3H2OFe(OH)3+3H+ , 酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体.

 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案


