题目内容
下列物质的熔点,前者大于后者的是
| A.晶体硅、碳化硅 | B.甲苯、苯酚 | C.氧化镁、氧化钠 | D.钾钠合金、钠 |
C
试题分析:A、晶体硅和碳化硅都是原子晶体,由于碳原子半径小于硅原子半径,所以碳化硅中共价键强于晶体硅中共价键,因此晶体硅的熔点小于碳化硅的熔点,A不正确;B、甲苯和苯酚形成的晶体都是分子晶体,由于苯酚的相对分子质量大于甲苯的,因此甲苯的熔点小于苯酚的熔点,B不正确;C、氧化镁和氧化钠形成的晶体都是离子晶体,但钠离子半径大于镁离子半径,所以氧化钠中离子键弱于氧化镁中离子键,因此氧化镁的熔点高于氧化钠的熔点,C正确;D、合金的熔点一般低于各成分金属的熔点,所以钠钾合金的熔点低于金属钠的熔点,D不正确,答案选C。

练习册系列答案
相关题目


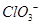 的空间构型为平面三角形
的空间构型为平面三角形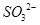 的中心原子均为sp3杂化
的中心原子均为sp3杂化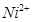 和
和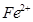 的离子半径分别为69pm和78pm,则熔点NiO_________________FeO(填“<”或“>”);
的离子半径分别为69pm和78pm,则熔点NiO_________________FeO(填“<”或“>”);