��Ŀ����
����Ŀ����ѧ��������A��B�ͼס��ҡ������ֻ���������ͼ��ʾ��ת����ϵ�����ֲ���δ�г���������A����ΪʳƷ��װ���ϣ�������������� 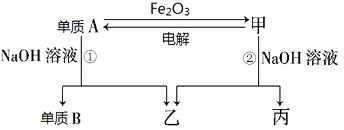
����ͼʾת����ϵ�ش�
��1��д���������ʵĻ�ѧʽ������A �� �� ��
��2��д������A��Fe2O3��Ӧ�Ļ�ѧ����ʽ�� �� ���ø÷�Ӧ��ԭ����������
��3���õ���A���ɵ��������Դ��������Ũ�����ԭ���� ��
��4��д����Ӧ�ٵ����ӷ���ʽ�� ��
��5����ҵ��ұ����������ͨ�� �����õ�ⷨ���� ��
a��Na b��Mg c��Fe d��Ag
��6�������ۺ�Fe2O3�����ȷ�Ӧʵ�飬��Ҫ���Լ�����
a��KCl b��KClO 3 c��MnO2 d��Mg��
���𰸡�
��1��Al��NaAlO2
��2��2Al+Fe2O3 ![]() Al2O3+2Fe�����ӽ�����
Al2O3+2Fe�����ӽ�����
��3��Al������Ũ���ᷢ���ۻ�
��4��2Al+2OH��+2H2O=2AlO2��+3H2��
��5��cd
��6��bd
���������⣺����A����ΪʳƷ��װ���ϣ����ǵ��͵����������A����������Ӧ�õ��ף���A����NaOH��Ӧ����AΪAl����ΪAl2O3 �� ����BΪH2 �� ��ΪNaAlO2 �� ��ΪNaAlO2.
��1.��AΪ����Al�����ǽ���Al������������Һ��Ӧ�õ��Ļ��������ΪNaAlO2 �� ���Դ��ǣ�Al��NaAlO2��
��2.������A��Fe2O3�����������ȷ�Ӧ���ʷ�Ӧ����ʽΪ��2Al+Fe2O3 ![]() Al2O3+2Fe�����ȷ�Ӧ��Ӧ��Ϊ���ӽ����ȣ����Դ��ǣ�2Al+Fe2O3
Al2O3+2Fe�����ȷ�Ӧ��Ӧ��Ϊ���ӽ����ȣ����Դ��ǣ�2Al+Fe2O3 ![]() Al2O3+2Fe�����ӽ����ȣ�
Al2O3+2Fe�����ӽ����ȣ�
��3.������������Ũ�����ڳ����¿��Է����ۻ����ʿ����ý������������������Ũ���ᣬ���Դ��ǣ�Al������Ũ���ᷢ���ۻ���
��4.����Ӧ�ٵ����ӷ���ʽΪ��2Al+2OH��+2H2O=2AlO2��+3H2�������Դ��ǣ�2Al+2OH��+2H2O=2AlO2��+3H2����
��5.��ұ�����ý���K��Ca��Na��Mg��Al��һ���õ�����ڵ��Ȼ��Al�ǵ�����ڵ�Al2O3���Ƶã��Ȼ�ԭ������ұ���ϲ����õĽ���Zn��Fe��Sn��Pb��Cu�����û�ԭ���У�C��CO��H2�ȣ����ȷֽⷨ��ұ�������õĽ���Hg��Ag�ü��ȷֽ�������ķ����Ƶã���ѡ��cd
��6.�����ȷ�Ӧ��Ҫ�������������·�Ӧ��þ���ڿ����п���ȼ�գ��������������������������еIJ���þ��ȼ��ʱ��������������������Ա�֤þ���ļ���ȼ�գ�ͬʱ�ų��㹻���������������������۵ķ�Ӧ����ѡ��bd��