题目内容
有关下列图像的说法正确的是
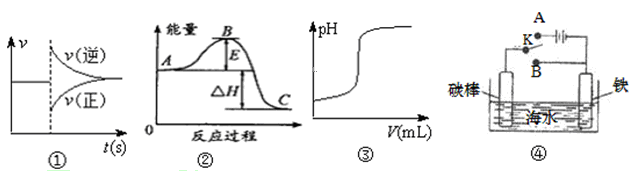
- A.曲线图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
- B.根据图②判断,物质A反应生成物质C的△H>0
- C.曲线图③可表示向一定量的硫酸溶液中滴加一定浓度氢氧化钠溶液时的pH变化
- D.开关K置于A或B处均可减缓铁的腐蚀
试题分析:A、曲线图①中改变条件后,逆反应速率增大,正反应速率降低,所以不可能改变的是温度,A不正确;
B、根据图②判断,物质A的总能量高于物质C的总能量,所以A生成C是放热反应,则△H<0,B不正确;
C、硫酸是强酸,氢氧化钠是强碱,因此曲线图③可表示向一定量的硫酸溶液中滴加一定浓度氢氧化钠溶液时的pH变化,C正确;
D、图④中开关K置于A时构成电解池,铁与电源的负极相连,做阴极,铁被保护;开关K置于B时构成原电池,铁是负极,失去电子被腐蚀,D不正确,答案选C。
考点:考查外界条件对反应速率和平衡状态的影响;反应热的判断;中和滴定曲线;金属的腐蚀与防护等

 教材全解字词句篇系列答案
教材全解字词句篇系列答案大气固氮(闪电时N2转化为NO)和工业固氮(合成氨)是固氮的重要形式。下表列举了不同温度下大气固氮和工业固氮的部分K值(K表示平衡常数):
| | N2+O2 2NO 2NO | N2+3H2 2NH3 2NH3 | ||
| 温度 | 25℃ | 2000℃ | 25℃ | 400℃ |
| K | 3.84×10-31 | 0.1 | 5×108 | 200 |
 氮的另一途径为 。
氮的另一途径为 。(2)根据表中的数据,并结合所学知识分析,下列说法正确的是 。
a.人类大规模模拟大气固氮实际意义很小
b.常温下,大气固氮与工业固氮完成程度相差很大
c.两种固氮都是放热反应 d.在常温下,大气固氮几乎不可能,而工业固氮很容易进行
(3)为研究反应条件的改变对化学平衡移动的影响,将N2和H2在一固定体积的密闭容器中进行反应,得到如下的图像。下列有关条件改变(每次只改变一个条件)的说法,正确的是 。

a.t2可能是增加了原料的物质的量
b.t4可能是充入了He气
c.t5是从反应体系中分离出氨气
d.t7时可能是升高温度,使平衡向正反应方向移动
(4)目前工业固氮采用的是哈伯法,即在20~50MPa的高压和500℃左右的
 高温下,并用铁触媒作为催化剂。俄勒冈大学的化学家使用了一种名为trans-Fe(DMeOPrPE)的新催化剂,在常温下合成氨,反应的化学方程式为:N2 +3H2
高温下,并用铁触媒作为催化剂。俄勒冈大学的化学家使用了一种名为trans-Fe(DMeOPrPE)的新催化剂,在常温下合成氨,反应的化学方程式为:N2 +3H2 2NH3。有关说法正确的是 。
2NH3。有关说法正确的是 。a.新法不需要高温条件,可节约大量能源
b.新法能在常温下进行是因为不需要断裂化学键
c.在相同温度下不同的催化剂其催化活性不同
大气固氮(闪电时N2转化为NO)和工业固氮(合成氨)是固氮的重要形式。下表列举了不同温度下大气固氮和工业固氮的部分K值(K表示平衡常数):
| N2+O2 | N2+3H2 | |||
| 温度 | 25℃ | 2000℃ | 25℃ | 400℃ |
| K | 3.84×10-31 | 0.1 | 5×108 | 200 |
(1)固氮是指 的过程,自然界固氮的另一途径为 。
(2)根据表中的数据,并结合所学知识分析,下列说法正确的是 。
a.人类大规模模拟大气固氮实际意义很小
b.常温下,大气固氮与工业固氮完成程度相差很大
c.两种固氮都是放热反应 d.在常温下,大气固氮几乎不可能,而工业固氮很容易进行
(3)为研究反应条件的改变对化学平衡移动的影响,将N2和H2在一固定体积的密闭容器中进行反应,得到如下的图像。下列有关条件改变(每次只改变一个条件)的说法,正确的是 。
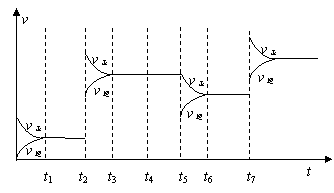 a.t2可能是增加了原料的物质的量
a.t2可能是增加了原料的物质的量
b.t4可能是充入了He气
c.t5是从反应体系中分离出氨气
d.t7时可能是升高温度,使平衡向
正反应方向移动
(4)目前工业固氮采用的是哈伯法,即在
20~50MPa的高压和500℃左右的高温下,并用铁触媒作为催化剂。俄勒冈大学的化学家使用了一种名为trans-Fe(DMeOPrPE)的新催化剂,在常温下合成氨,反应的化学方程式为:N2 +3H2![]() 2NH3 。有关说法正确的是 。
2NH3 。有关说法正确的是 。
a.新法不需要高温条件,可节约大量能源
b.新法能在常温下进行是因为不需要断裂化学键
c.在相同温度下不同的催化剂其催化活性不同
 2C(g),有关下列图像说法的不正确的是
2C(g),有关下列图像说法的不正确的是
 CH3OH(g),甲醇生成量与时间的关系如下图所示。
CH3OH(g),甲醇生成量与时间的关系如下图所示。
