题目内容
2.设阿伏加德罗常数的值为NA,下列说法中正确的是( )| A. | 1mol苯乙烯中含有的碳碳双键数为4NA | |
| B. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| C. | 0.1molCnH2n+2中含有的碳碳单键数为0.1nNA | |
| D. | 标准状况下,2.24LCHCl3含有的分子数为0.1NA |
分析 A、苯环不是单双键交替的结构;
B、乙烯和丙烯的最简式均为CH2;
C、依据烷烃结构特征计算碳碳键;
D、标况下,三氯甲烷为液态.
解答 解:A、苯环不是单双键交替的结构,即苯环中不含双键,故1mol苯乙烯中含1mol双键,即NA个,故A错误;
B、乙烯和丙烯的最简式均为CH2,故28g混合物中含有的CH2的物质的量n=$\frac{2.8g}{14g/mol}$=0.2mol,故含有0.2mol碳原子,即0.2NA个,故B正确;
C、0.1molCnH2n+2中含有的碳碳单键数=0.1mol×(n-1)NA=0.1NA(n-1),故C错误;
D、标况下,三氯甲烷为液态,故不能根据气体摩尔体积来计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
12.下列物质不能由单质直接化合生成的是( )
| A. | CuCl2 | B. | NO2 | C. | FeCl3 | D. | Na2O2 |
13.下列各项中表达正确的是( )
| A. | 第三周期元素形成的最高价氧化物对应的水化物中,酸性最强的是HClO4 | |
| B. | 水分子很稳定性是因为水分子间易形成氢键 | |
| C. | 用电子式表示HCl形成过程:H-+${\;}_{\;}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$→H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]- | |
| D. | 第VⅡA族元素形成的氢化物中沸点最高的是HI |
10.温度为500℃时,反应4NH3+5O2=4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v(x)为( )
| A. | v(O2)=0.01mol/(L•s) | B. | v(NO)=0.08mol/(L•s) | ||
| C. | v(H2O)=0.002mol/(L•s) | D. | v(NH3)=0.002mol/(L•s) |
17.不属于高分子化合物的正确组合是( )
①甘油 ②油脂 ③纤维素 ④淀粉 ⑤有机玻璃 ⑥蛋白质 ⑦蔗糖 ⑧天然橡胶 ⑨2,4,6-三硝基甲苯(TNT) ⑩涤纶.
①甘油 ②油脂 ③纤维素 ④淀粉 ⑤有机玻璃 ⑥蛋白质 ⑦蔗糖 ⑧天然橡胶 ⑨2,4,6-三硝基甲苯(TNT) ⑩涤纶.
| A. | ①④⑥⑦ | B. | ①②⑦⑨ | C. | ③⑤⑥⑩ | D. | ②③⑦⑧ |
14.在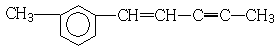 分子中,下列说法正确的是( )
分子中,下列说法正确的是( )
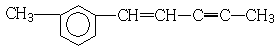 分子中,下列说法正确的是( )
分子中,下列说法正确的是( )| A. | 处于同一平面上的原子数最多可能有12个 | |
| B. | 1mol该分子最多可以与3molH2加成 | |
| C. | 该分子含有三种官能团 | |
| D. | 该物质能使溴水和高锰酸钾溶液褪色 |
11.下列叙述正确的是( )
| A. | 同周期元素的原子半径以ⅦA族的为最大 | |
| B. | 在周期表中0族元素的电负性最大 | |
| C. | ⅠA族元素的原子,其半径越大第一电离能越小 | |
| D. | 所有主族元素的原子形成单原子离子时的最高价数都和它的族数相等 |
12.已知X、Y是主族元素,I为电离能,单位是KJ/mol.根据下表所列数据判断错误的是( )
| 元素 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 578 | 1817 | 2745 | 11600 |
| A. | 元素X的常见化合价是+1价 | |
| B. | 元素Y是ⅢA族的元素 | |
| C. | 元素X与氯形成化合物时,化学式可能是XCl | |
| D. | 若元素Y处于第3周期,它可与冷水剧烈反应 |
 由图中的实验装置可用于制取乙炔,请回答
由图中的实验装置可用于制取乙炔,请回答